Νευροενδοκρινείς όγκοι (NETs)
Οι νευροενδοκρινικοί όγκοι (NETs) είναι νεοπλάσματα που προκύπτουν από κύτταρα του ενδοκρινικού και νευρικού συστήματος. Πολλοί είναι καλοήθεις, ενώ μερικοί είναι κακοήθεις. Πιο συχνά συμβαίνουν στο έντερο, όπου συχνά καλούνται καρκινοειδείς όγκοι άλλα επίσης στον πνεύμονα και το υπόλοιπο του σώμα.
Αν και υπάρχουν πολλά είδη τέτοιων όγκων, αντιμετωπίζονται ως μια ομάδα, επειδή τα κύτταρα των νεοπλασμάτων αυτών μοιράζονται κοινά χαρακτηριστικά, όπως το ότι δείχνουν όμοια, έχοντας ειδικά εκκριτικά κοκκία, και συχνά παράγουν βιογενείς αμίνες και πολυπεπτιδικές ορμόνες.
Ιστορία
Οι νευροενδοκρινείς όγκοι του λεπτού εντέρου διακρίθηκαν πρώτα από άλλους όγκους το 1907. Ονομάστηκαν καρκινοειδείς όγκοι επειδή η αργή ανάπτυξη τους θεωρήθηκε ότι είναι «όπως ο καρκίνος» και όχι πραγματικά καρκινική.
Ωστόσο, το 1938 αναγνωρίστηκε ότι μερικοί από αυτούς του όγκους του λεπτού εντέρου θα μπορούσε να είναι κακοήθεις. Παρά τις διαφορές μεταξύ αυτών των δύο αρχικών κατηγοριών, και την περαιτέρω πολυπλοκότητα λόγω συνεπακόλουθης συμπερίληψης των νευροενδοκρινών όγκων του παγκρέατος και των νευροενδοκρινών όγκων πνευμονική προέλευσης, όλα τα NETs μερικές φορές (εσφαλμένα) οι μη ειδικοί τα εντάσσουν στον όρο του «καρκινοειδούς.»
Τα enterochromaffin κύτταρα, τα οποία δημιουργούν τους καρκινοειδείς όγκους, εντοπίστηκαν το 1897 από τον Kulchitsky και τους έκκριση της σεροτονίνης από αυτά ανακαλύφθηκε το ιδρύθηκε το 1953, όταν το flushing η (έξαψη) αναγνωρίστηκε κλινικά. Η Καρδιακή νόσος του καρκινοειδούς εντοπίστηκε το 1952 και η ίνωση του καρκινοειδούς το 1961.
Τα NETs μερικές φορές αποκαλούνταν APUDomas επειδή αυτά τα κύτταρα αυτών προσλαμβάνουν και αποκαρβοξυλιώνουν amine precursor (L-DOPA and 5-hydroxytryptophan) για την παραγωγή των βιογενών αμινών όπως κατεχολαμινών και σεροτονίνης. Αν και αυτή η συμπεριφορά ήταν επίσης μέρος της αναπόδεικτης υπόθεσης ότι όλα αυτά τα κύτταρα προσέρχονται εμβρυολογικά από την νευρική ακρολοφία (neural crest) τα νευροενδοκρινικών κύτταρα παράγουν μερικές φορές διάφορων τύπων ορμόνες και αμίνες, και μπορούν επίσης να έχουν ισχυρούς υποδοχείς για άλλες ορμόνες στις οποίες ανταποκρίνονται.
Ονοµατολογία- ταξινόµηση
Υπήρξαν πολλαπλά συστήματα ονοματολογίας/κατηγοριοποίησης για αυτούς τους όγκους, και οι διαφορές μεταξύ αυτών προκαλούν σύγχυση. Οι όγκοι αυτοί έχουν διάφορα συνώνυμα που χρησιμοποιούνται καμιά φορά και σήμερα, όπως «καρκινοειδείς όγκοι» «APUDomas», «γάστρο- έντερο-παγκρεατικοί όγκοι (GEP)», «νησιδιακοί όγκοι», «νευροενδοκρινείς όγκοι», «νευροενδοκρινή καρκινώματα».
Έτσι σήμερα ακολουθούμε την τελευταία κατάταξη της ΠΟΥ (WHO) του 2010 που συνοδεύεται από τον βαθμό διαφοροποίησης (grade).
- Νευροενδοκρινής όγκος γαστρεντερικού G1 (καρκινοειδές)
- Νευροενδοκρινής όγκος G2
- Νευροενδοκρινές καρκίνωμα (NEC), (μέγαλο- και μικροκυτταρικού τύπου) (εξ ορισμού G3)
- Μικτό αδενονευροενδοκρινικό καρκίνωμα (MANEC)
- Υπερπλαστικές βλάβες και προκακοήθειες
|
Διαφοροποίηση των GEP-NETS |
||
|
Βαθμού 1 (G1) |
Βαθμού 2 (G2) |
Βαθμού 3 (G3) |
|
Μιτωτική μέτρηση, <2 ανά 10 HPF ≤ 2 Ki-67 LI |
Μιτωτική μέτρηση 2-20 ανά HPF 3-20% Ki-67 LI |
Μιτωτική μέτρηση > 20 ανά HPF 20% Ki-67 LI |
|
HPF: high power fields, LI: labeling index |
Στην κατάταξη αυτή έγιναν σαφή τα κάτωθι:
- Η κακοήθης δυνατότητα των νευροενδοκρινών νεοπλασμάτων αναγνωρίζεται και υπογραμμίζεται σαφώς
- Ο όρος ‘’νευροενδοκρινής’’ τώρα και επίσημα υιοθετήθηκε για να τονίσει τα νεοπλασματικά κύτταρα που εκφράζουν νευρικούς δείκτες όπως η συναπτοφυσίνη.
- Ο όρος νευροενδοκρινές νεόπλασμα (neuroendocrine neoplasm) αντικατέστησε το όρο νευροενδοκρινής όγκος (neuroendocrine tumor)
- Ο όρος ‘’ΝΕΤ’’ καλύπτει όλα τα καλά και κακώς διαφοροποιημένα ΝΕΤς
- Τα καθαρά ΝΕΤs του ΓΕΣ και του παγκρέατος (GEP-NETs) χωρίζονται σε 3 ομάδες (πίνακας 2):
a. Τα χαμηλού grade ΝΕΤς (G1) εδώ ανήκουν τα παλιά ‘’καρκινοειδή’’
b. Ενδιαμέσου grade ΝΕΤς (G2)
c. Τα υψηλού grade ΝΕΤς (G3) που ονομάζονται και νευροενδοκρινή καρκινώματα (NECs).
Η τοποθέτηση ενός δεδομένου όγκου σε μία των κατηγοριών εξαρτάται σαφώς από τα σαφώς καθορισμένα ιστολογικά χαρακτηριστικά: που είναι το μέγεθος, η λεμφική και αγγειακή διήθηση, ο μιτωτικός δείκτης, ο δείκτης πολλαπλασιασμού Ki-67, η διήθηση γειτονικών οργάνων, η παρουσία των μεταστάσεων και εάν παράγουν ορμόνες.
Συχνότητα
Αν και οι εκτιμήσεις ποικίλλουν, η ετήσια συχνότητα εμφάνισης κλινικά σημαντικών νευροενδοκρινικών όγκων είναι περίπου 2.5-5 ανά 100.000 τα 2/3 είναι καρκινοειδείς όγκοι (πρώτη μεγάλη κατηγορία) και το 1/3 είναι άλλα ΝΕΤς (η δεύτερη μεγάλη κατηγορία)
Ανατοµική κατανοµή των NETs
Τα NETs μπορούν να ανευρεθούν σε πολλές διαφορετικές περιοχές του σώματος, και βρίσκονται πιο συχνά στους ενδοκρινείς αδένες, στο ΓΕΣ (πεπτικό σύστημα) ή τους πνεύμονες. Όμως είναι απόλυτα σαφές ότι οι NETs είναι ασυνήθιστοι σε πολλές από αυτές τις περιοχές, και συχνά αντιπροσωπεύουν μόνο ένα πολύ μικρό ποσοστό των όγκων ή των καρκίνων σε αυτές τις τοποθεσίες.
Αν θέλαμε από την κεφαλή μέχρι τα νύχια να τα τοποθετήσουμε ανατομικά είναι ως εξής:
- Υπόφυση (πρόσθια)
- Θυρεοειδής αδένας
a. Ειδικά το μυελοειδές καρκίνωμα του θυροειδούς - Παραθυρεοειδής
- Θύμος και μεσοθωράκιο
- Πνεύμονας
a.Βρόγχοι
b. Πνευμονικά καρκινοειδή (typical carcinoid (TC; low-grade); atypical carcinoid (AC; intermediate-grade)
c. Μικροκυτταρικός καρκίνος του πνεύμονα (small-cell lung cancer, SCLC)
d. Μεγαλοκυτταρικό νευροενδοκρινικό καρκίνωμα του πνεύμονα (large-cell neuroendocrine carcinoma (LCNEC of the lung)) - Εξωπνευμονικά μικροκυτταρικά καρκινώματα (Extrapulmonary small cell carcinomas (ESCC or EPSCC))
- Γαστροεντεροπαγκρετικά NETs (Gastro-enteropancreatic neuroendocrine tumors (GEP-NET))
a. NETs από το αρχέγονο πρόσθιο έντερο (Foregut GEP-NETs, εννοιολογικά οι όγκοι αυτοί προέρχονται από τον οισοφάγο, τον στόμαχο το 12/λο μέχρι και την 2η μοίρα, το ήπαρ τα χοληφόρα και το πάγκρεας)
b. NETs από το αρχέγονο μέσο έντερο (Midgut GEP-NETs, από το τέλος της 2ης μοίρας του 12/λου μέχρι και τα κεντρικά 2/3 του εγκαρσίου κόλου συμπεριλαμβανομένης και της σκωληκοειδούς)
c. ΝΕΤς από το αρχέγονο τελικό έντερο (Hindgut GEP-NETs, από το τελικό 1/3 του εγκαρσίου κόλου μέχρι και το ορθό) - Ήπαρ και χοληδόχος κύστη
- Όγκοι των επινεφριδίων ειδικά της μυελώδους μοίρας
a. Φαιοχρωμοκύτωμα - Όγκοι του περιφερικού νευρικού συστήματος όπως Schwannoma, paraganglioma, neuroblastoma
- Μαστός
- Ουρογεννητικό σύστημα
a. Καρκινοειδές του ουροποιητικού και νευροενδοκρινές καρκίνωμα
b. Ωοθήκες
c. Νευροενδοκρινής όγκος του τραχήλου της μήτρας
d. Όρχεις - Καρκίνωμα Merkel cell του δέρματος (trabecular cancer)
- Πολλές συγγενείς παθήσεις:
a. MEN Ι
b. MEN ΙΙ
c. Νόσος von Hippel-Lindau (VHL)
d. Νευροϊνωμάτωση τύπου Ι (neurofibromatosis type 1)
e. Οζώδης σκλήρυνση (tuberous sclerosis)
f. Σύμπλεγμα Carney
Γενικά τα ενδοκρινή νεοπλάσματα μπορούν να διαιρεθούν σύμφωνα με τη χημική φύση των προϊόντων έκκρισής τους, σε δύο ομάδες. Τα νεοπλάσματα που παράγουν και εκκρίνουν γλυκοπρωτεϊνικές ορμόνες και βιογενείς αμίνες περιλαμβάνουν την πρώτη ομάδα (πχ. ινσουλίνωμα). Η δεύτερη ομάδα περιλαμβάνει τους όγκους που παράγουν τις στεροειδείς ορμόνες (πχ. όγκοι φλοιού επινεφριδίων).
Οι όγκοι της πρώτης ομάδας [και δη αυτοί του παγκρέατος (pNETs)], είναι αυτοί που θα ασχοληθούμε στο παρόν κεφάλαιο, καλούνται νευροενδοκρινή νεοπλάσματα (ΝΕΤs) λόγω των πρωτεϊνών δεικτών τους οποίους μοιράζονται με το νευρικό σύστημα (ΝΣ). Αυτοί Οι δείκτες είναι η συναπτοφυσίνη (synaptophysin) και η neuron-specific enolase (NSE). Άλλοι δείκτες με νευροενδοκρινή φαινότυπο είναι οι χρωμογρανίνες (chromogranins) Α, Β και C, και οι προπρωτεϊνικές κονβερτάσες (convertases proprotein) PC2 και PC3. Κάτω Από το ηλεκτρονικό μικροσκόπιο τα ΝΕΤs παρουσιάζει χαρακτηριστικούς νευροεκκριτογόνους κόκκους και όλα αυτά τα στοιχεία είναι κοινά στα GEP-NEΤs (foregut, midgut και hindgut προέλευσης) στα όποια περιλαμβάνονται φυσικά και τα pNETs ως όγκοι εκ του foregut.
Νευροενδοκρινείςόγκοι του Παγκρέατος
Το αντικείμενο της παρούσας παρουσίασης είναι μόνο ένα τμήμα των NETs και ειδικά των GEP-NETs (πρακτικά το 1/3 αυτών) τα pNETs (δηλαδή οι νευροενδοκρινείς όγκοι του παγκρέατος .
Η ιστορία των ενδοκρινών (νευροενδοκρινών) νεοπλασμάτων του παγκρέατος (PNETs, PanΝΕΤs, PNETs) είναι παράλληλη με την ιστορία των νησιδίων του παγκρέατος, ανεξάρτητα αν σήμερα θεωρούμε ότι οι όγκοι αυτοί δεν συνδέονται κυρίαρχα με τα νησίδια παρόλο που πολλοί χειρουργοί ακόμα τους αποκαλούν νησιδιακούς όγκους .
Τα νησίδια του παγκρέατος αποτελούνται από τα ενδοκρινή κύτταρα του οργάνου, είναι δε διάχυτα διεσπαρμένα σε όλο το πάγκρεας. Πρώτη φορά που περιεγράφηκαν ήταν το 1869, όταν ο Paul Langerhans, φοιτητής τότε της Ιατρικής, περιέγραψε τις συλλογές αυτών των ωχρών κυττάρων μέσα στο πάγκρεας, τα νησίδια, που φέρουν τώρα την επωνυμία του. Το 1908, ο A.G. Nichols πρώτος δημοσίευσε περίπτωση ασθενούς με ένα απλό αδένωμα νησιδίων. Το 1922 οι Frederick Banting, ένας ορθοπεδικός, και ο Charles Best, ένας φοιτητής της Ιατρικής στο Toronto, ανακάλυψαν την ινσουλίνη, και σύντομα έκτοτε, η ουσία αυτή διατέθηκε για τη θεραπεία του διαβήτη.
Η χειρουργική των pNETs άρχισε πριν από 80 περίπου χρόνια όταν απεδείχθη χειρουργικά από τον William J. Mayo, η σχέση μεταξύ υπερινσουλινισμού και ενός ανεγχείρητου παγκρεατικού καρκινώματος εκ νησιδιακών κυττάρων (4 Δεκεμβρίου 1926, αλλά ανακοινώθηκε από τον Wilder το 1927). Η πρώτη χειρουργική θεραπεία του ινσουλινώματος επιτεύχθηκε από τον Roscoe Graham στο Τορόντο το 1929 αν και μόλις το 1935, οι Whipple και Frantz περιέγραψαν τη διαγνωστική τριάδα του ινσουλινώματος: συμπτώματα υπογλυκαιμίας, χαμηλές συγκεντρώσεις γλυκόζης αίματος, και ανακούφιση των συμπτωμάτων από τη χορήγηση της γλυκόζης. Το 1955, οι R.M. Zollinger και E.H. Ellison δημοσίευσαν μελέτη με δύο ασθενείς με πολλαπλή οξεία νόσο πεπτικού έλκους με συνοδό μαζική όξινη υπερέκκριση του στομάχου και όγκο του παγκρέατος από μη-βήτα νησιδιακά κύτταρα. Εν συνεχεία οι Mort Grossman και Rod Gregory βρήκαν ότι εκκριτογόνος ουσία ήταν η ορμόνη-πεπτίδιο γαστρίνη.
Το 1977, δύο ασθενείς με παραγωγή σωματοστατίνης, από όγκους νησιδιακών κυττάρων περιεγράφηκαν σε χωριστές μελέτες. Έκτοτε διαφόρων τύπων νησιδιακοί όγκοι έχουν περιγραφεί και συνεχίζουν να ταξινομούνται στους όγκους της Ενδοκρινούς μοίρας του παγκρέατος (Ε.Μ.Π.).
Σήμερα όμως αυτοί οι ‘’νησιδιακοί όγκοι’’ θεωρούμε ότι ξεκινούν από πολυδύναμα βλαστικά κύτταρα του επιθηλίου των παγκρεατικών πόρων, παρά από τα νησίδια του Langerhans. Για αυτόν τον λόγο, η χρήση του όρου, ενδοκρινής η νευροενδοκρινής όγκος του παγκρέατος (pNET) έχει πλέον επικρατήσει, και η χρήση παλαιότερων όρων, όπως ο όγκος νησιδιακών κυττάρων κ.λ.π. πρέπει να σταματήσει.
Οι Νευροενδοκρινικών όγκοι του παγκρέατος μπορεί να προέρχονται από πάγκρεας ή από παρόμοια νευροενδοκρινικά κύτταρα έξω από το πάγκρεας. Τα pNETs είναι διαφορετικοί όγκοι από τη συνηθισμένη μορφή του καρκίνου του παγκρέατος, το πορογενές αδενοκαρκίνωμα, το οποίο εμφανίζεται στην εξωκρινή μοίρα του παγκρέατος. Περίπου το 95%των παγκρεατικών όγκων είναι αδενοκαρκίνωμα, και μόνο 1 ή 2% των κλινικά σημαντικών όγκων του παγκρέατος είναι pNETs.
Προέλευση
Παρόλο που τα PNETs (δηλαδή τα ΝΕΤς του παγκρέατος η PNETs) δεν προέρχονται από τα κύτταρα που θα περιγράψουμε πιο κάτω όπως παλιά πιστεύαμε, θεωρούμε χρήσιμο αυτά και οι ιδιότητες των ορμονών που παράγουν να περιγραφούν για διδακτικούς και ιστορικούς λόγους και φυσικά θα καταλάβουμε την αλλαγή που είχε η προσέγγιση των όγκων αυτών τα τελευταία 30 χρόνια.
Τα ενδοκρινή κύτταρα του παγκρέατος που ανευρίσκονται εντός των νησιδίων του παγκρέατος στον ενήλικα είναι 5 κυρίων τύπων:
- τα Α (α) κύτταρα εκκρίνουν γλουκαγόνο
- τα Β (β) εκκρίνουν ινσουλίνη
- τα Δ (D, δ) εκκρίνουν σωματοστατίνη
- τα Δ2 (D2, δ2) εκκρίνουν το αγγειοενεργό εντερικό πεπτίδιο (vasoactive intestinal peptide -VIP),
- και τα PP η F κύτταρα εκκρίνουν το παγκρεατικό πολυπεπτίδιο (PP).
Άλλα σπάνια κύτταρα είναι τα κύτταρα εντεροχρωμαφίνης (EC), και τα κύτταρα γαστρίνης (G) που είναι παρόντα κανονικά μόνο στο εμβρυϊκό πάγκρεας και όχι στο πάγκρεας του ενήλικα. Αυτά τα έκτοπα G κύτταρα μπορούν να γίνουν εστίες γαστρινωμάτων στο πάγκρεας, το 12/λο η και σε άλλες παρακείμενες δομές.
Το πλείστο των ορμονών και πεπτιδίων που παράγονται από τα κύτταρα αυτά, έχουν τα χαρακτηριστικά και τις λειτουργίες των κλασικών ορμονών:
- η απελευθέρωσή τους ακολουθεί ένα φυσιολογικό ερέθισμα
- έχουν τη δυνατότητα να προκαλέσουν απάντηση σε ένα απομεμακρυσμένο όργανο- στόχο
- αυτά τα αποτελέσματα αναπαράγονται μιμούνται από την εξωγενή χορήγηση της ορμόνης
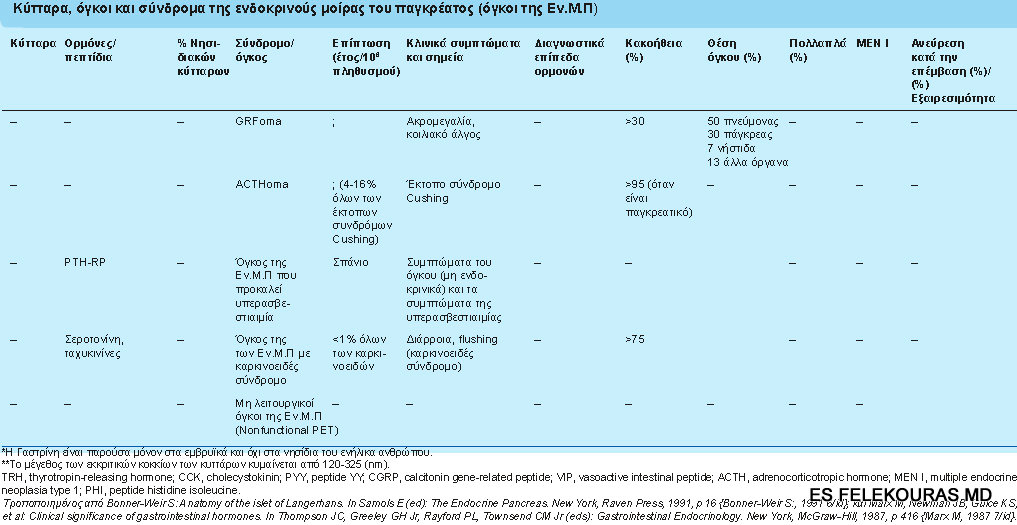
Σε αντίθεση, μερικά πεπτίδια που παράγονται από τους όγκους αυτούς δεν έχουν κανένα γνωστό κλινικό ορμονικό αποτέλεσμα. Τα σύνδρομα που δημιουργεί η υπερβολική παραγωγή των ορμονών αυτών από το αντίστοιχο PΝΕΤ, ονομάζονται από το πεπτίδιο του οποίου τα συμπτώματα υπερέχουν όπως πχ. ινσουλινώματα, γλυκαγονώματα κλπ. (εικόνα 1) και αυτό δεν έχει αλλάξει όλα αυτά τα χρόνια.
Εικόνα 1: Κύτταρα, όγκοι και σύνδρομα της ενδοκρινούς μοίρας του παγκρέατος (όγκοι της Ε.Μ.Π.)
Ένα μεγάλο ποσοστό των όγκων της Ε.Μ.Π (pNETs), παραμένει ασυμπτωματικό όπως αποδεικνύεται από την επίπτωση αυτών των όγκων σε σειρές αυτοψίας (1.500 ανά 100.000) έναντι της χαμηλής κλινικής επίπτωσής τους (1 ανά 100.000).
Στην παρουσίαση αυτή μας ενδιαφέρουν μόνο τα παγκρεατικά και περιπαγκρεατικά GEP-NETs (όπως του 12/λου και της αρχικής (κεντρικής) νήστιδας, της αμπούλας του Vater αλλά και όλων των πιο σπανίων εντοπίσεων των νεοπλασμάτων του ΗΠΧ συμπλέγματος). (για τα περιπαγκρεατικά GEP-NETs βλέπε: Πρωτοπαθή νευροενδοκρινή νεοπλάσματα σπανίας εντόπισης κατά μήκος του σπληνοπυλαίου άξονα).
Δωδεκαδάκτυλο και κεντρική νήστιδα.
Τα ΝΕΤς στην περιοχή αυτή είναι τα εξής:
- ΝΕΤς που παράγουν Γαστρίνη
a. Με ΣΖΕ (πχ γαστρίνωμα)
b. Χωρίς ΣΖΕ - ΝΕΤς που παράγουν Σωματοστατίνη
a. με νευροϊνωμάτωση τύπου Ι (NF1)
b. χωρίς νευροϊνωμάτωση τύπου Ι (NF1) - ΝΕΤς που παράγουν Σεροτονίνη η Καλτσιτονίνη
- Γαγγλιοκυτταρικά παραγαγγλιώματα
- Πτωχά διαφοροποιημένα νευροενδοκρινή καρκινώματα (NECs)
Αυτά τα δωδεκαδακτυλικά ΝΕΤs μπορούν να διαιρεθούν σε λειτουργικά και μη λειτουργικά ΝΕΤς.
Πάγκρεας
Τα περισσότερα παγκρεατικά ΝΕΤς (PNETs) είναι μονήρη, καλά αφοριζόμενα από τα πέριξ και καλά διαφοροποιημένα νεοπλάσματα. Το μέγεθος τους είναι συνήθως μεταξύ 1-5 cm. Οι πολλαπλοί όγκοι είναι σπάνιοι και πρέπει πάντα όταν ανιχνεύονται, να γεννούν την υποψία ΜΕΝ-1 ή VHL. Το μέγεθος (>2 cm), η διηθητική τοπική επέκταση, οι μεταστάσεις, η αγγειακή διήθηση και η πολλαπλασιαστική τους δραστηριότητα στην βιοψία, καθορίζουν την πρόγνωση και την μεταστατική τους δυνατότητά . Αυτή η πολυπαραγοντική θεώρηση των διαφόρων μεταβλητών των όγκων αυτών είναι μια αξιόπιστη μέθοδος στην κατάταξη των όγκων αυτών σε ομάδες κίνδυνου.
Τα καλά διαφοροποιημένα pNETs (PanΝΕΤs) μπορεί αν είναι:
- Λειτουργικά (F-pNETs)
a. Ινσουλίνωμα
b. Γαστρίνωμα
c. Γλουκαγόνωμα
d. VIPομα
e. Αλλά πιο σπάνια - Μη λειτουργικά (NF-pNETs)
Τα NF-pNETs παρατηρούνται συχνότερα από παλιότερα, αν και αυτό πιθανώς δεν απεικονίζει μια αληθινή αύξηση σε αριθμό, αλλά μάλλον βελτιωμένες διαγνωστικές μεθόδους. Από την άποψη της σχετικής συχνότητας αντιπροσωπεύουν τουλάχιστον το 60% όλων των PNETs.
Λειτουργικά και μη λειτουργικά pNETs εμφανίζονται σε ενηλίκους, αλλά με μια ευρεία όρια ηλικιών (20-80 έτη). Είναι σπάνια στα παιδιά. Τα περισσότερα είναι σποραδικά, αλλά μερικά μπορούν να εμφανιστούν στις κληρονομικές διαταραχές όπως στο ΜΕΝ-1 την VHL και στην NF1. Τα pNETs που είναι κακά διαφοροποιημένα (PanNECs), είναι σπάνια.
Κλινική εικόνα
Η συμπτωματολογία των νευροενδοκρινών όγκων του παγκρέατος είναι αποτέλεσμα:
- των ορμονών που παράγουν
- των πιεστικών φαινομένων που προκαλεί η τοπική ανάπτυξή τους, και
- των μεταστάσεων
Ανάλογα με την ορμόνη που παράγουν, προκαλούν πέντε κύρια κλινικά σύνδρομα:
- το σύνδρομο του ινσουλινώματος
- το σύνδρομο του γαστρινώματος
- το σύνδρομο του γλυκαγονώματος
- το σύνδρομο του VIPόματος ή παγκρεατικής χολέρας, και
- το σύνδρομο του σωματοστατινώματος.
Τα pNETs έχουν διάφορες εμφανίσεις και έτσι διαφέρουν πολύ στον τρόπο έναρξης, στη σοβαρότητα των συμπτωμάτων, στην ανατομική τους θέση και στο βαθμό κακοήθειας. Με το χρόνο ένας τέτοιος όγκος μπορεί να αλλάξει συμπεριφορά καθώς και οι ορμόνες που εκκρίνει, αλλάζοντας έτσι και τη βιολογική του συμπεριφορά. Η εικόνα που έχουμε για την κλινική εμφάνιση γενικά μιας κατηγορίας νεοπλασμάτων είναι τόσο μεγάλη που διαφέρει από ασθενή σε ασθενή καθώς και στον ίδιο τον άρρωστο με την πάροδο του χρόνου. Έτσι ένας ασθενής μπορεί σήμερα να εμφανίζει ένα κλινικό σύνδρομο, ενώ με την πάροδο του χρόνου είναι δυνατόν να αναπτυχθεί ένα δεύτερο (ίδιος όγκος με άλλες ορμόνες). Γενικά λοιπόν οι όγκοι αυτοί χαρακτηρίζονται από την κλινική εικόνα που παράγει η εκκρινόμενη ορμόνη που υπερέχει, μια και ένας όγκος ή ακόμη και ένα κύτταρό του μπορεί να παράγει πολλές διαφορετικές ορμόνες. Τα ευρήματα αυτά συνηγορούν υπέρ της θεωρίας της προέλευσης των κυττάρων αυτών από ανώριμα αρχέγονα κύτταρα, ή ακόμα και από τα κύτταρα των πόρων. Μέχρι 40% των ασθενών με νευροενδοκρινείς όγκους του παγκρέατος παράγουν πολλές ορμόνες, οι οποίες όμως δεν προκαλούν όλες συμπτώματα.
Στα NF-pNETs (μη λειτουργικά) περιλαμβάνονται όγκοι με ιστολογικά χαρακτηριστικά ενός pNET, αλλά χωρίς ανίχνευση υψηλών επιπέδων κάποιας ορμόνης στον όρο. Οι όγκοι αυτοί αποτελούν σήμερα τουλάχιστο το 50% όλων των PNETs. Σε αυτή την κατηγορία ανήκαν μέχρι πρόσφατα τα PPώματα και οι όγκοι που παράγουν νευροτενσίνη (neurotensinomas), που δεν προκαλούν κανένα σύνδρομο.
Συχνά, λόγω του ότι τα κλινικά σύνδρομα που δημιουργούνται από τα pNETs δεν έχουν πολύ χαρακτηριστική κλινική εικόνα, η διάγνωση καθυστερεί, με αποτέλεσμα ο όγκος να είναι ήδη αρκετά εκτεταμένος κατά τη διάγνωσή του. Η διάγνωση των νευροενδοκρινών όγκων του παγκρέατος περιλαμβάνει:
- την αναγνώριση του κλινικού συνδρόμου που προ- καλούν
- την ανίχνευση στο περιφερικό αίμα της αντίστοιχης ορμόνης και των ειδικών καρκινικών δεικτών, και
- την ανατομική εντόπιση του όγκου.
Η εντόπισή του δεν είναι πάντα εύκολη, σε αυτό δε θα αναφερθούμε διεξοδικά εν συνεχεία.
Ένα άλλο κοινό χαρακτηριστικό των pNETs είναι, ότι κατά κανόνα μεθίστανται στο ήπαρ. Ιδιαίτερα ενδιαφέρον είναι ότι σε περίπτωση μεταστατικής νόσου η κλινική πορεία καθίσταται αρκετά βραδεία με παρατεταμένη επιβίωση, σε αντίθεση με άλλους όγκους όπου οι μεταστάσεις στο ήπαρ οδηγούν γρήγορα σε ηπατική ανεπάρκεια και το θάνατο.
Από κλινικής πλευράς τα πιο σπουδαία στάδια στη διάγνωση και θεραπεία των ενδοκρινών όγκων του παγκρέατος είναι ο εντοπισμός τους και η κατάλληλη χειρουργική θεραπεία.
Κλινικά, στην αξιολόγηση των ασθενών με τους όγκους αυτούς, είναι σημαντικό να γίνει κατανοητό ότι- εκτός της ύπαρξης λειτουργικότητας η όχι- φαίνεται να υπάρχουν δύο διαφορετικοί τύποι ασθενών με τέτοιους όγκους. Η πρώτη ομάδα αποτελείται από εκείνους τους ασθενείς που έχουν τους όγκους των χωρίς σημαντικές ενδοκρινικές διαταραχές στο προσωπικό ή οικογενειακό ιστορικό (σποραδικοί όγκοι). Η δεύτερη ομάδα περιλαμβάνει εκείνους με σαφή ένδειξη μιας κληρονομούμενης προδιάθεσης με αυτοχρωμοσωματικό επικρατούντα χαρακτήρα στα πλαίσια ενδοκρινικού συνδρόμου ΜΕΝ-1.
Διάγνωση
Η διάγνωση όλων αυτών των όγκων εκτός από την κλινική εικόνα που δεν είναι ιδιαίτερα διαγνωστική για τον καθένα από αυτά, βασίζεται στην ανάπτυξη ακριβών μετρήσεων των ορμονών του πεπτικού στον ορό των ασθενών με ραδιοανοσολογικές μεθόδους (RIA, σε pg/mL) κα. Ιδιαίτερη βοήθεια στην διάγνωση και θεραπεία των συνδρόμων προσθέτουν οι διάφορες τεχνικές εντοπισμού των PNETs όταν δεν ανευρίσκονται με τις κλασσικές απεικονιστικές μεθόδους.
Καρκινικοί δείκτες
Η διάγνωση των PNETs στηρίζεται κυρίως στη θετική αξιολόγηση των δεικτών της νευροενδοκρινούς διαφοροποίησης με ανοσοϊστοχημεία. Οι συνηθέστερα χρησιμοποιημένοι δείκτες είναι οι γενικοί νευροενδοκρινείς (εφαρμόσιμοι σε όλα τα νευροενδοκρινή κύτταρα), ανευρίσκονται δε είτε στο κυτταρόπλασμα, όπως η ενολάση των νευρώνων (NSE) και το γονιδιακό πρωτεϊνικό προϊόν 9,5 (PGP 9,5), είτε στα εκκριτικά κοκκία (κυτταρόπλασμα), όπως η χρωμογρανίνη Α είτε στην κυτταρική μεμβράνη όπως η συναπτοφυσίνη
Η χρωμογρανίνη Α, θεωρείται ο ακριβέστερος γενικός δείκτης στη διάγνωση των NETs, η δε ευαισθησία της ειδικά για τα λειτουργικά pNETs είναι 96% και για τα μη λειτουργικά 75%. Έτσι οι όγκοι αυτοί ιστολογικά χαρακτηρίζονται από την παρουσία νευροεκκριτικών κοκκίων τα οποία δίνουν θετική τη χρώση χρωμογρανίνης Α, κάτι που αποτελεί και μέθοδο ιστολογικής ανίχνευσής τους. Οι χρωμογρανίνες είναι παρούσες σχεδόν σε όλους τους ενδοκρινείς ή νευρικούς ιστούς. Τα επίπεδα πλάσματος της χρωμογρανίνης Α (CgA) βρίσκονται υψηλά σε περισσότερο από το 90% των ασθενών με διάφορα pNETs, χωρίς τα επίπεδα αυτά να είναι σίγουρο ότι συμπεριφέρονται ως δείκτες κακοήθειας όπως είχε παλαιότερα λεχθεί. Το παγκρεατικό πολυπεπτίδιο (PP) έχει προταθεί επίσης για να διαδραματίσει αυτό το ρόλο, αλλά δεν χρησιμοποιείται λόγω της χαμηλής ευαισθησίας και ειδικότητας που έχει (54% και 57% αντίστοιχα) στα PNETs. Ο συνδυασμός και των δύο αυτών πεπτιδίων για τα pNETs και για τα NF-pNETs συγκριτικά με τη χρωμογρανίνη, δίνει ευαισθησία που ανέρχεται στο 95% έναντι 75%.
Η νευροενδροκρινική εκκριτική πρωτεΐνη-55 (NESP- 55) που εντοπίζεται κυρίως στα εκκριτικά κοκκία των ΝΕ κυττάρων (είναι μέλος της οικογένειας της χρωμογρανίνης), φαίνεται να είναι ειδική για τα PNETs και τα φαιοχρωμοκυτώματα, επειδή τα καρκινοειδή του εντέρου είναι αρνητικά για το NESP-55 αλλά είναι θετικά για χρωμογρανίνη Α. Αυτή η παρατήρηση βοηθά στον εντοπισμό των μικρών pNETs.
Αρκετά πρόσφατα, μια νέα γαστρεντερική ορμόνη η γρελίνη (ghrelin) που παράγεται από τα ανθρώπινα γαστρικά Χ-like νευροενδοκρινή κύτταρα και που έντονα διεγείρει την έκκριση αυξητικής ορμόνης (GH), έχει ανιχνευθεί στα PNETs. Οι όγκοι αυτοί μπορεί να εκφράζουν γρελίνη και υποδοχείς γρελίνης, αλλά δεν έχει ακόμη παρατηρηθεί σαφές κλινικό σύνδρομο υπερπαραγωγής αυτής της ορμόνης. Ο ρόλος της γρελίνης ίσως αποδειχθεί βοηθητικός στο μέλλον. Φυσικά ο εντοπισμός τέτοιων ουσιών συνεχώς προχωρά [π.χ. secretagogin, Chromogranins B, και C, Prohormone convertases PC1/3 και PC2, Synaptic vesicle protein 2 (SV2), VMATs, VAMPs, Synaptotagmins, Neuropilin-2, Somatostatin receptors, L1 και άλλων].
Απεικονιστικές εξετάσεις
Τα pNETs είναι, όπως έχει λεχθεί, υπεύθυνα για κλινικά σύνδρομα λόγω της υπερπαραγωγής ορμονών και πεπτιδίων. Ο ακριβής εντοπισμός όμως κάποιου PNETS είναι αρκετά δύσκολη υπόθεση και απαιτεί μια ιδιαίτερη μεθοδολογία που καμιά φορά είναι πολύπλοκη, πανάκριβη και πολλές φορές αποτυγχάνει.
Πρόσφατα, διάφορες μελέτες έχουν ερευνήσει τη σχετική χρησιμότητα των διαθέσιμων σήμερα τεχνικών και έχουν βοηθήσει να καθιερωθεί ένας συστηματικός απεικονιστικός έλεγχος.
Εντοπισµός των PNETs (Tumor Localization)
Εκτός του απλού υπερηχογραφήματος, σε περιπτώσεις ευμεγέθων βλαβών (διαμέτρου πάνω από 1 cm), η αξονική τομογραφία (ΑΤ) διπλής φάσης, η μαγνητική τομογραφία και το ενδοσκοπικό υπερηχογράφημα (EUS) του παγκρέατος μας αποκαλύπτουν την αλλοίωση σε πολύ υψηλά ποσοστά. Δεν ισχύει το ίδιο όμως και στις περιπτώσεις μικρότερων βλαβών. Εάν υπάρχει έντονη η υποψία νευροενδοκρινούς όγκου και οι παραπάνω απεικονιστικές εξετάσεις δεν καταδεικνύουν κάποια βλάβη μπορεί να χρησιμοποιηθεί το σπινθηρογράφημα με οκτρεοτίδη, και τέλος η εκλεκτική αγγειογραφία του κοιλιακού άξονα (μια και οι όγκοι αυτοί είναι ιδιαιτέρως αγγειοβριθείς) με ή χωρίς εκλεκτική λήψη αίματος από τις ηπατικές φλέβες ή την πυλαία φλέβα με διαδερμικό καθετηριασμό τους και ανίχνευση της αντίστοιχης ορμόνης. Η οκτρεοτίδη είναι ένα συνθετικό ανάλογο της σωματοστατίνης που δεσμεύεται από τους υποδοχείς 2 και 5 της φυσικής ορμόνης. Οι περισσότεροι νευροενδοκρινείς όγκοι του παγκρέατος (εκτός από το ινσουλίνωμα) φέρουν τέτοιους υποδοχείς οπότε το σπινθηρογράφημα με οκτρεοτίδη μπορεί να μας τους αποκαλύψει. Η εξέταση αυτή εκτός από την αρχική διάγνωση και εντόπιση του όγκου, χρησιμοποιείται και για την αποκάλυψη τυχών δευτεροπαθών εντοπίσεων.
Η απλή ΑΤ και MRI εντοπίζει λιγότερο από 10% των pNETs διαμέτρου <1 cm, 30-40% των όγκων 1-3 cm και περισσότερο από 50% των όγκων >3 cm. Η σύγχρονη ΑΤ (Dual-face helical CT) μπορεί να μας δώσει ευαισθησίες μέχρι και 92%, αν και ο πλέον σύγχρονος τύπος ΑΤ (MDCT) θεωρείται ότι θα δώσει ακόμη μεγαλύτερη ευαισθησία και ειδικότητα στην ΑΤ. Η MRI (T1-weighted fat suppression images) έχει ευαισθησία μέχρι και 91%, θεωρείται δε πιο ευαίσθητη τεχνική για τον έλεγχο των οστικών και ηπατικών μεταστάσεων σε ασθενείς με PNETs και συνιστάται και για τον έλεγχο της απάντησης στη θεραπεία. Μεταξύ των άλλων εξετάσεων η ΑΤ είναι η πιο συχνά χρησιμοποιούμενη ως αρχική εξέταση λόγω της γενικής διαθεσιμότητάς της.
Από τις συνήθεις επεμβατικές μελέτες απεικόνισης, η εκλεκτική αγγειογραφία είναι η πλέον ευαίσθητη για τον εντοπισμό των μικρών PNETs, προσδιορίζοντας το 60% των μικρών PNETs όπως τα ινσουλινώματα και το 70% των άλλων PNETs.
Τα ινσουλινώματα καθώς και τα γαστρινώματα του δωδεκαδακτύλου είναι συνήθως μικρά (<1 cm) κατά τη διάγνωση σε αντίθεση με τα άλλα PNETs που είναι μεγάλα (>4 cm) και παρουσιάζονται πολύ καθυστερημένα. Επιπλέον τα ινσουλινώματα, τα γλυκαγονώματα, τα VIPώματα και τα NF-pNETs στους ενήλικες σχεδόν πάντα βρίσκονται στο πάγκρεας, ενώ στα παιδιά τα VIPώματα, τα γαστρινώματα και τα σωματοστατινώματα εμφανίζονται συχνά εξωπαγκρεατικά.
Ακόμη και με τις συνεχείς βελτιώσεις στις διαγνωστικές εξετάσεις, ένας σημαντικός αριθμός (40-60%) μικρών πρωτοπαθών όγκων και ένα ποσοστό (5-30%) των ασθενών με μεταστατική νόσο στο ήπαρ, δεν μπορούν να ανιχνευθούν σήμερα με τις κλασικές μεθόδους απεικόνισης (υπερηχογράφημα, ελικοειδής ΑΤ, MRI). Πλέον εξελιγμένες μέθοδοι διάγνωσης και εντοπισμού των PNETs χρησιμοποιούνται όπως το σπινθηρογράφημα με οκτρεοτίδη (SRS) αλλά και το EUS και άλλες εξετάσεις.
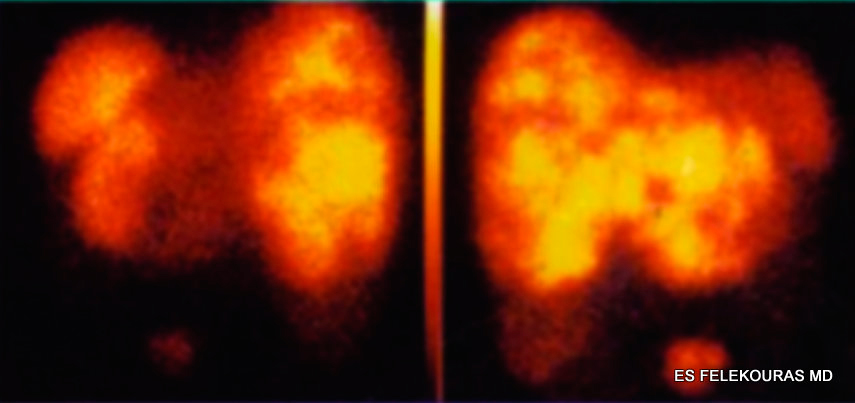
Το SRS είναι η εξέταση με το υψηλότερο ποσοστό αληθώς θετικών αποτελεσμάτων για τα PNETs, μια και το αδενοκαρκίνωμα του παγκρέατος δεν εκφράζει υποδοχείς σωματοστατίνης. Έτσι φαίνεται ότι από τις κλασικές και μη επεμβατικές μεθόδους απεικόνισης έχει τη μεγαλύτερη ευαισθησία ακόμα και αν συνδυασθούν όλες οι άλλες μη επεμβατικές διαγνωστικές μέθοδοι και φυσικά είναι η κύρια μέθοδος απεικόνισης της μεταστατικής νόσου (ήπαρ, οστά κ.λπ.). Πρέπει όμως να σημειωθεί ότι έχει ψευδώς θετικά αποτελέσματα στο 12%. Λόγω της υψηλής ευαισθησίας του και της δυνατότητάς του να λάβει ολόσωμες εικόνες, το SRS με 111In-octreotide θεωρείται η αρχική εξέταση επιλογής για τα NETs και τα pNETs (εικόνα 2). Η απεικόνιση με 123I-MIBG έχει πτωχή ευαισθησία στον προσδιορισμό των PNETs και δεν μπορεί να χρησιμοποιηθεί γενικά σε περιπτώσεις με αρνητικό SRS με 111In-octreotide.
Εικόνα 2: Ανάδειξη υποδοχέων σωματοστατίνης στο ήπαρ με SRS.
Πρόσφατες μελέτες καταδεικνύουν ότι EUS είναι μια ευαίσθητη μέθοδος για των ανίχνευση των PNETs, είναι δε ευαίσθητο όσο και οι μέθοδοι καθετηριασμού, με ανίχνευση βλαβών μέχρι και 5 mm. Το EUS είναι ιδιαίτερα ευαίσθητο για τον προσδιορισμό των PNETs μέσα στο πάγκρεας (>85%) και σε μερικές μελέτες, ειδικά για τα ινσουλινώματα, είναι σαφώς πιο ευαίσθητο από το SRS. Αν και υπάρχει ένα πιθανό τυφλό σημείο στις πύλες του σπληνός, θεωρείται ότι η εξέταση αυτή ανιχνεύει όλους τους όγκους που καταδείχθηκαν από οποιοδήποτε άλλη συμβατική τεχνική (εκτός του SRS με 111In-octreotide) πράγμα που θέτει υπό αμφισβήτηση την ανάγκη για τις άλλες μορφές απεικόνισης. Κατά μια μελέτη έχει ευαισθησία 93% και ειδικότητα 95% στον εντοπισμό των ενδοπαγκρεατικών βλαβών. Το πρόβλημα είναι ότι συνιστά μια εξέταση όχι ευρέως διαδεδομένη, ειδικά στα ελληνικά νοσοκομεία, απαιτεί δε μεγάλη εμπειρία, ενώ το SRS μπορεί να εκτελεσθεί στα περισσότερα τμήματα πυρηνικής ιατρικής ή ακτινολογίας.
Παρόλα αυτά, ούτε το SRS ούτε το EUS ανιχνεύει τα μικρά εξωπαγκρεατικά PNETs, ειδικά δε τα δωδεκαδακτυλικά γαστρινώματα, αν και ο συνδυασμός των δύο μεθόδων έχει προταθεί ότι αυξάνει την ευαισθησία μιας εκάστης μεθόδου ανίχνευσης για τους όγκους αυτούς.
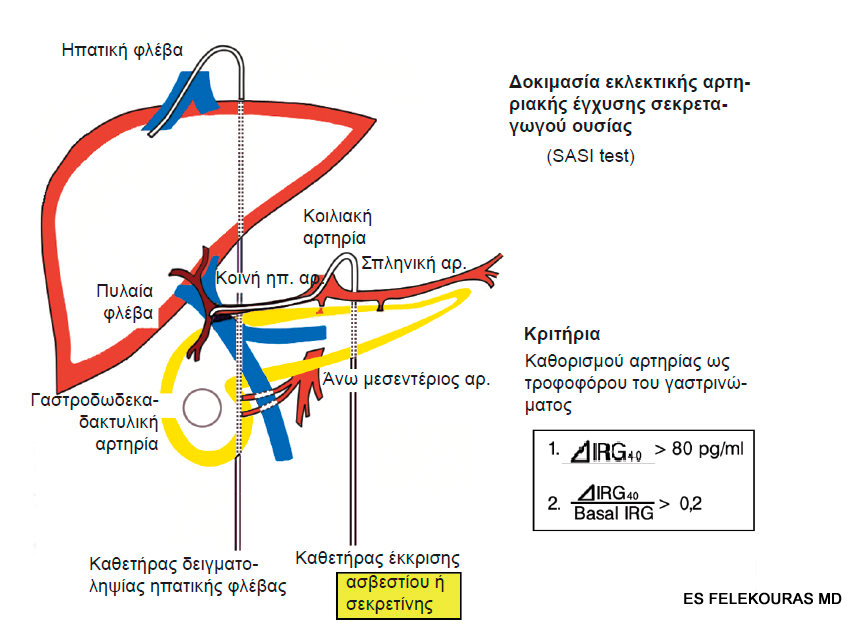
Ο λειτουργικός εντοπισμός των όγκων με τον καθορισμό της περιοχής του παγκρέατος με τη μέγιστη ορμονική έκκριση μετά από εκλεκτικό φλεβικό καθετηριασμό και φλεβική δειγματοληψία, είναι μια χρήσιμη τεχνική σε μερικές καταστάσεις. Αρχικά αυτή η προσέγγιση ήταν ιδιαίτερα δύσκολη επειδή απαιτούνταν διηπατικός καθετηριασμός με δειγματοληψία από κλάδους της πυλαίας φλέβας, όπως και οι επιπλοκές ήταν συχνές (20%). Σήμερα έχει περιγραφεί μια απλουστευμένη μέθοδος, με δειγματοληψία αίματος κυρίως από τη δεξιά ηπατική φλέβα μέσω διαδερμικού διασφαγιτιδικού καθετηριασμού της, ο οποίος φαίνεται να έχει μεγαλύτερη ευαισθησία από την προηγούμενη τεχνική. Με τη μέθοδο αυτή (SASI test) χρησιμοποιούνται διάφορα εκκριτογόνα, όπως η σεκρετίνη για τα γαστρινώματα ή το ασβέστιο για τα ινσουλινώματα. Η εκλεκτική ενδαρτηριακή έγχυση των εκκριτογόνων αυτών κατά τη διάρκεια της αγγειογραφίας, με σύγχρονη αιμοληψία από την ηπατική φλέβα, βοηθά στον εντοπισμό γαστρινωμάτων και ινσουλινωμάτων που δεν έχουν ανιχνευθεί με άλλο τρόπο. Έτσι αν π.χ. έχει γίνει έγχυση στη σπληνική αρτηρία και το αίμα που θα ληφθεί μετά από αυτή εμφανίζει αύξηση της ορμόνης που διεγέρθηκε προς παραγωγή με τη χορήγηση του εκκριτογόνου, τότε ο όγκος ευρίσκεται στο σώμα ή την ουρά του παγκρέατος. Συνεπώς μια περιφερική παγκρεατεκτομή θα θεραπεύσει τον ασθενή. Πιο ακριβής εντοπισμός μπορεί να γίνει αν ο καθετήρας της αρτηρίας προωθηθεί σε πιο περιφερικά αγγεία (π.χ. γαστροδωδεκαδακτυλική αρτηρία) (βλ. Εικόνα 3). Ηπατικές μεταστάσεις μπορεί να ανιχνευθούν αν ληφθεί αίμα από τη δεξιά και αριστερή ηπατική φλέβα όταν το εκκριτογόνο εγχύεται στην κοινή ηπατική αρτηρία. Η έγχυση του ασβεστίου δεν προκαλεί μόνο αύξηση της παραγωγής της ινσουλίνης από τα ινσουλινώματα, αλλά και των ορμονών από VIPώματα, PPώματα, γλυκαγονώματα, γαστρινώματα, GRFόματα και σωματοστατινώματα. Σε μια συγκριτική μελέτη που περιελάμβανε ινσουλινώματα που είναι μικρά και δύσκολα στην ανεύρεσή τους, η μέθοδος της διεγερτικής αγγειογραφίας εμφάνιζε την υψηλότερη ευαισθησία, με θετικά ευρήματα στο 88% των ασθενών. Οι αντίστοιχες τιμές ευαισθησίας ήταν για το US 9%, για την AT 17%, για τη MRI 43%, για την εκλεκτική αγγειογραφία 36% και τέλος για τη λήψη αίματος πυλαίας φλέβας (portal venous sampling) χωρίς διέγερση 67%.
Εικόνα 3: Η διεγερτική αγγειογραφία ή SASI test. H μέθοδος είναι αποτελεσματική επειδή τα κύτταρα του γαστρινώματος απελευθερώνουν γαστρίνη όταν ερεθίζονται με σεκρετίνη ή ασβέστιο. Έτσι με τη δοκιμασία αυτή ανιχνεύονται γαστρινώματα >1 mm και περισσότερα από το 90% των γαστρινωμάτων <5 mm εντοπίζονται σωστά.
Δυστυχώς, η ποζιτρονιακή τομογραφία (PET) δεν ικανοποίησε τις προσδοκίες απεικόνισης των NETs και ιδιαίτερα των pNETs, και μόνο όγκοι με υψηλό δείκτη πολλαπλασιασμού και χαμηλή διαφοροποίηση παρουσιάζουν υψηλή πρόσληψη φθοριοδεοξυγλυκόζης. Από τα διάφορα παράγωγά της, μόνο αυτό που είναι σεσημασμένο με 11 C-labeled amine precursor L-dihy- droxyphenylalanine και 5-hydroxy-L-tryptophan (5-HTP) (11C-5-HTP PET) φαίνεται ότι σκιαγραφεί ικανοποιητικά μερικούς από αυτούς τους όγκους και σύμφωνα με ορισμένους συγγραφείς παρέχει καλύτερα αποτελέσματα από τις κλασικές μεθόδους απεικόνισης (ΑΤ, MRI).
Μπορεί να χρησιμοποιηθεί για την εξέταση του θώρακα και της κοιλίας. Η έλλειψη γενικής διαθεσιμότητας και το υψηλό κόστος περιορίζει τη χρήση της.
Ερευνητική λαπαροτοµία για PNETs
Ανάμεσα στις άλλες μεθόδους εντοπισμού ενός pNET σημαντική θέση έχει και η ερευνητική λαπαροτομία όπου και με την βοήθεια διαφόρων τεχνικών (IOUS, ενδοσκόπηση κ.λ.π.) καταλήγουμε στον εντοπισμό ενός pNET
Το διεγχειρητικό σπινθηρογράφημα το οποίο όμως είναι διαθέσιμο σε λίγα μόνο κέντρα του εξωτερικού, μπορεί να χρησιμοποιηθεί για να βοηθήσει να καθορίσει την ακριβή θέση ενός βιοχημικά αποδεδειγμένου PNETS και να βελτιώσει στην πλήρη εξαίρεσή του.
Θεραπεία
Η χειρουργική θεραπεία των όγκων αυτών πέρασε και περνά από συνεχή εξέλιξη μια και οι όγκοι αυτοί είναι σπάνιοι (5 περιπτώσεις/106 πληθυσμού/έτος) και έτσι χρειάσθηκε χρόνος για να μπορέσουμε να διαπιστώσουμε την λογική στρατηγική που πρέπει να ακολουθούμε στην θεραπεία τους. Η προσέγγιση του ασθενούς με έναν τέτοιο όγκο πρέπει να είναι εξατομικευμένη κατά κάποιο τρόπο, ισορροπώντας μεταξύ της θεραπείας του κλινικού συνδρόμου υπερπαραγωγής ορμονών με τα συμπτώματα εκ της μάζας του όγκου. Η θεραπεία πρέπει να κατευθυνθεί όχι μόνο από την παρουσία συμπτωμάτων (ορμονικών η μη), αλλά και από μια εκτίμηση της σχετικά μακράς φυσικής ιστορίας των όγκων αυτών.
Στις πιο ειδικές παρουσιάσεις που ακολουθούν αυτό το κείμενο θα αναφερθούμε πιο διεξοδικά σε καθένα από τα pNETs.