Γενικά επί των Λειτουργικών pNETs (NF-pNETs)
Πρόγνωση
Με τις σημερινές δυνατότητες φαρμακευτικού ελέγχου της υπερπαραγωγής των ορμονών, η επιβίωση των ασθενών με PNETs καθορίζεται όλο και περισσότερο από τη βιολογία του όγκου και τη φυσική του εξέλιξη. Σύγχρονες μελέτες δεικνύουν ότι τα PNETs έχουν διάφορους ρυθμούς ανάπτυξης σε διαφορετικούς ασθενείς. Έτσι βλέπουμε ότι σε μελέτες που παρακολούθησαν ασθενείς με γαστρινώματα για μεγάλο διάστημα το 25% αυτών είχαν επιθετική συμπεριφορά, ενώ το υπόλοιπο 75% παρέμειναν σχετικά αδρανείς. Ομοίως και σε ασθενείς με ηπατικές μεταστάσεις μόνο το 40% δείχνει επιθετική συμπεριφορά, είναι δε αυτοί που έχουν τα πιο πτωχά αποτελέσματα με κάθε είδους θεραπεία. Έτσι σήμερα υπάρχουν προγνωστικοί παράγοντες οι οποίοι είναι κλινικά χρήσιμοι με το σημαντικότερο δυσμενή προγνωστικό παράγοντα σε όλες τις μελέτες, να είναι η ανάπτυξη των ηπατικών μεταστάσεων.
Δυσμενείς προγνωστικοί παράγοντες (μικρή επιβίωση) σε F-pNETs
- μεταστάσεις (κυρίως ηπατικές)
- αδρή διήθηση γειτονικών οργάνων
- αγγειακή διήθηση
- περινευρική διήθηση
- διάμετρος όγκου >2 cm
- μιτώσεις >2 ανά 10 HPF
- Ki-67 (MIB-1) >2%
- Νέκρωση
Θεραπεία
Πριν εφαρμοστεί οποιοδήποτε είδος θεραπείας στους ασθενείς με PNETs, η πιθανότητα ΜΕΝ Ι πρέπει πάντα να εξεταστεί, επειδή υπάρχει διαφορά στο χειρισμό των όγκων αυτών όταν εμφανίζονται ως τμήμα του συνδρόμου ΜΕΝ Ι.
Η χειρουργική επέμβαση παραμένει η θεραπεία επιλογής και η μόνη προσέγγιση που μπορεί να επιτύχει ίαση σε ασθενείς με pNETs.
Χειρουργική θεραπεία
Πρόσφατα, η χειρουργική προσέγγιση έχει γίνει επιθετικότερη, με ευρείες εκτομές συμπεριλαμβανομένων και εκτομής των μεταστάσεων σε συνδυασμό με χημειοεμβολισμό μέσω της ΗΑ και με τοπικές τεχνικές καταστροφής του όγκου.
Σχεδόν όλοι οι ασθενείς με λειτουργικά pNETs πρέπει να υποβάλλονται σε ερευνητική λαπαροτομία με κύριο σκοπό την πλήρη εξαίρεση του όγκου.
Οι στόχοι της ερευνητικής αυτής λαπαροτομίας είναι:
- η ακριβής σταδιοποίηση
- η πλήρης εκτομή (R0)
- η προπαρασκευή για συντηρητική θεραπεία σε μη εξαιρέσιμους όγκους.
Η νέα ιστολογική ταξινόμηση των pNETs μας δίνει αρκετά αξιόπιστα κριτήρια για τη διάκριση μεταξύ καλοήθων και κακοήθων και ακόμη και μεταξύ οριακής κακοήθειας όγκων. Όμως τα κριτήρια αυτά καμία βοήθεια δεν προσφέρουν όταν διεγχειρητικά πρέπει να αποφασίσουμε για την έκταση της εκτομής μας ούτε έχουν καμία προγνωστική αξία για κάθε ασθενή ξεχωριστά, μια και το προγνωστικό όριο είναι μεταξύ PNETs οριακής κακοήθειας και κακοήθων όγκων (τοπική διήθηση και περιοχικές και απομεμακρυσμένες μεταστάσεις) αλλά όχι μεταξύ καλοήθων pNETs και οριακής κακοήθειας.
Για το λόγο αυτό η χειρουργική επέμβαση βοηθά τα μέγιστα στη σταδιοποίηση αφού η ανίχνευση εγχειρητικά λεμφαδενικών ή ηπατικών μεταστάσεων μπορεί να είναι ο μόνος δείκτης κακοήθειας προεγχειρητικά. Για το λόγο αυτό η ερευνητική λαπαροτομία πρέπει να είναι πολύ ενδελεχής και επιμελής για έλεγχο πιθανόν μεταστάσεων και ιδιαίτερα περιοχικών λεμφαδένων.
Η μόνη λοιπόν πιθανά θεραπευτική μέθοδος αντιμετώπισης είναι η χειρουργική εξαίρεση (R0) και αυτή μπορεί να απαιτεί μια μεγάλη επέμβαση παγκρεατεκτομής (με σπληνεκτομή αν είναι περιφερική) και συνοδό εκτομή γειτονικών οργάνων (όπως στομάχου, παχέος εντέρου και αριστερού επινεφριδίου), ηπατεκτομή και καμιά φορά και εκτομή πνευμονικών μεταστάσεων για να επιτευχθεί μακρά επιβίωση. Η συνοδός εξαίρεση αγγείων του σπληνοπυλαίου άξονα όταν διηθούνται, σε ασθενείς χωρίς απομακρυσμένες μεταστάσεις (ήπαρ κ.λπ.) δικαιολογείται μια και τα pNETs έχουν την καλύτερη δυνατή πρόγνωση που μπορεί να έχει ένας τέτοιος όγκος παγκρέατος. Λόγω λοιπόν του μεγέθους της επέμβασης ο χειρουργός πρέπει να έχει σαφή γνώση τι να περιμένει από την επέμβαση και να το συγκρίνει με το τι προσφέρει η συντηρητική θεραπεία σε κάθε ασθενή με έναν τέτοιο όγκο.
Όταν ο όγκος κριθεί ανεγχείρητος τότε ο χειρουργός πρέπει να αλλάξει πλάνο και να προετοιμάσει διεγχειρητικά τον ασθενή με τις κατάλληλες επεμβάσεις που θα επιτρέψουν το θεραπευτικό χειρισμό του για μακρύ διάστημα συντηρητικά. Έτσι ασθενείς που θα υποβληθούν σε θεραπεία με ανάλογα σωματοστατίνης θα πρέπει να υποβληθούν σε χολοκυστεκτομή για πρόληψη των επιπλοκών της χοληδόχου κύστεως από τη χορήγηση αυτών, οι ασθενείς που έχουν υψηλά επίπεδα ACTH μπορεί να χρειαστεί να υποστούν σε αμφωτερόπλευρη επινεφριδεκτομή, οι ασθενείς που έχουν πυλωρική απόφραξη ή ίκτερο να υποβληθούν σε ΓΕΑ ή χολοπεπτική αναστόμωση, αντίστοιχα.
Σήμερα στο οπλοστάσιο των χειρουργών για την αντιμετώπιση της μεταστατικής νόσου του ήπατος υπάρχουν και άλλα όπλα όπως το RFA, ή το cryoablation, αλλά ακόμη δεν είναι σαφές στη διεθνή βιβλιογραφία ποιοι είναι οι ασθενείς εκείνοι που θα ωφεληθούν από τη χρήση τους. Εκείνο όμως που είναι σαφές είναι ότι βοηθούν τα μέγιστα στην προσπάθειά μας να καταστήσουμε έναν ανεγχείρητο ασθενή εγχειρήσιμο.
Αντιµετώπιση της µεταστατικής νόσου του ήπατος από pNETs
Ένα μικρό ποσοστό των NETs του ήπατος είναι πρωτοπαθή νεοπλάσματα. Η μεγάλη πλειονότητα αυτών (98%) είναι μεταστατικά. Η ηπατεκτομή συνιστά πιθανότατα τη θεραπεία επιλογής για τους όγκους αυτούς όπως π.χ. για το πρωτοπαθές γαστρίνωμα του ήπατος που προσφέρει μια πιθανότητα ίασης 30%.
Η παρουσία ηπατικών μεταστάσεων είναι η σφραγίδα της κακοήθειας των NET όγκων και ο κύριος αρνητικός προγνωστικός παράγοντας. Στο 50% των περιπτώσεων υπάρχουν ηπατικές μεταστάσεις κατά τη στιγμή της διάγνωσης, εκτός από τα ινσουλινώματα που μεθίστανται στο ήπαρ λιγότερο συχνά. Αυτό σημαίνει ότι οι ασθενείς αυτοί σπάνια καταλήγουν από τους πρωτοπαθείς όγκους τους (στόμαχο, έντερο, πάγκρεας) αν δεν έχουν ηπατικές μεταστάσεις. Επομένως η παρουσία μεταστάσεων στο ήπαρ σε τέτοιους ασθενείς είναι ενδεικτικό προϊούσας νόσου και αν αφεθεί χωρίς θεραπεία η κατάληξη σε άλλοτε άλλο χρόνο είναι βέβαιη. Φυσικά με τα μέχρι σήμερα δεδομένα οι απομεμακρυσμένες μεταστάσεις αποκλείουν τη χειρουργική επέμβαση.
Οι ασθενείς με εκτεταμένη ηπατική νόσο ακολουθούν μακρά και ήπια κλινική πορεία, σε αντίθεση με τις ηπατικές μεταστάσεις από άλλα κακοήθη νεοπλάσματα που σύντομα οδηγούν σε ηπατική ανεπάρκεια και θάνατο. Όταν δίνουν συμπτώματα, αυτά συνήθως σχετίζονται με την υπερπαραγωγή της αντίστοιχης ορμόνης ή με το μεγάλο μέγεθος του όγκου.
Δύο πράγματα πρέπει να έχει κανείς στο μυαλό του όταν προγραμματίζει τη θεραπεία της μεταστατικής νόσου ασθενών με pNETs.
- Πρώτον πολλοί από αυτούς με τους ανωτέρω όγκους έχουν μακρά επιβίωση ακόμα και εάν δεν ακολουθήσουν καμία θεραπεία, πράγμα που κάνει την εκτίμηση των αποτελεσμάτων κάθε θεραπείας πολύ δύσκολη.
- Δεύτερον, λόγω των κλινικών συμπτωμάτων της υπερπαραγωγής της ορμόνης, στόχος πολλές φορές είναι η βελτίωση ή η εξάλειψη του κλινικού συνδρόμου και λιγότερο η επιμήκυνση της ζωής, γεγονός όχι απαραίτητα ορθό.
Ο ρόλος της επιθετικής χειρουργικής θεραπείας των ασθενών αυτών είναι αμφισβητούμενος για διάφορους λόγους όπως:
- οι όγκοι αυτοί είναι σπάνιοι
- οι μελέτες είναι μικρές και αναδρομικές
- δεν υπάρχουν διπλές τυφλές μελέτες
- τα καρκινοειδή συμπεριλαμβάνονται στις μελέτες αυτές αλλά η βιολογική τους συμπεριφορά διαφέρει των άλλων ΝΕΤs
- οι μελέτες συμπεριλαμβάνουν λειτουργικούς και μη λειτουργικούς όγκους
- τα αποτελέσματα της χειρουργικής θεραπείας στα συμπτώματα και την κλινική εικόνα δεν διαχωρίζονται από την επίδραση της χειρουργικής θεραπείας στην επιβίωση πάρα πολλές φορές π.χ. ασθενείς με μεταστάσεις από ινσουλίνωμα όταν τα συμπτώματά τους δεν ελέγχονται ικανοποιητικά συντηρητικά, φαίνεται ότι ωφελούνται από την ηπατεκτομή μια και τα συμπτώματά τους ελέγχονται καλύτερα με αυτόν τον τρόπο. Αντίθετα, για ασθενείς με NF-pNETs που είναι συνήθως ασυμπτωματικοί ή με γαστρινώματα (που τα συμπτώματα ελέγχονται πολύ καλά με PPIs) το όφελος από την επέμβαση μπορεί να εκτιμηθεί μόνο από την επίπτωση στην επιβίωση
- δεν έχει επαρκώς μελετηθεί η θεραπευτική ικανότητα της χειρουργικής θεραπείας σε ασθενείς με ηπατικές μεταστάσεις (R0) έτσι δεν υπάρχουν σαφή κριτήρια ποιος μπορεί να χειρουργηθεί και ποιος όχι.
Η χειρουργική αντιμετώπιση των ηπατικών μεταστάσεων των νευροενδοκρινών όγκων του παγκρέατος μπορεί να έχει στόχο θεραπευτικό ή παρηγορητικό. Απομακρυσμένες μεταστάσεις πέραν του ήπατος πρέπει να αποκλείουν την επέμβαση εκτός ιδιαιτέρων περιπτώσεων. Θεραπευτικό αποτέλεσμα επιτυγχάνεται μόνο με την πλήρη εξαίρεση των αλλοιώσεων, κάτι που είναι εφικτό σε λιγότερο από 10% (5-15%) των ασθενών με ηπατικές μεταστάσεις, αν και τώρα το ποσοστό αυτό βελτιώνεται σημαντικά.
Θα πρέπει εδώ να τονιστεί ότι τα καλύτερα αποτελέσματα επιτυγχάνονται μόνο με R0 ή R1 εκτομή. Ενώ ιστορικά η 5ετής επιβίωση των ασθενών αυτών είναι 30%, η 5ετής και 10ετής αντίστοιχη μετά από χειρουργική εξαίρεση είναι 71-85% και 35%, αποδεικνύοντας ότι η χειρουργική επέμβαση μπορεί τουλάχιστον να επιβραδύνει την πρόοδο της νόσου, άρα είναι καλύτερη από τη συντηρητική θεραπεία (βλ. Εικόνα 1). Έτσι η πραγματική πενταετής επιβίωση μπορεί να επιτευχθεί με τις συνθήκες αυτές σε πάνω από το 50% των ασθενών, είναι δε πολύ καλύτερη από την επιβίωση ασθενών χωρίς θεραπεία. Δυστυχώς δεν υπάρχουν διπλές τυφλές μελέτες που να αποδεικνύουν αυτά τα δεδομένα.
Εικόνα 1: Επιβίωση ασθενών μετά από ηπατεκτομή για μεταστατικό νευροενδοκρινές νεόπλασμα.
Πολλοί υποστηρίζουν ότι οι περισσότερες από αυτές τις μελέτες περιέχουν ασθενείς με μικρούς μεταστατικούς όγκους που υπεβλήθησαν σε R0 εκτομή ή RFA, οι οποίοι όμως έτσι και αλλιώς θα είχαν καλή πρόγνωση συγκριτικά με τη χειρότερη πρόγνωση που εμφανίζουν ασθενείς με πιο προχωρημένη νόσο στις ομάδες που δεν χειρουργήθηκαν. Οι ασθενείς με μικρή και περιορισμένη στο ήπαρ νόσο (<5 εστίες στον ένα ή και στους δύο λοβούς) αποτελούν μια μικρή ομάδα (5-15%) των πασχόντων με μεταστατική νόσο του ήπατος από NETs έτσι φαίνεται ότι η χειρουργική θεραπεία έχει ρόλο μόνο σε ένα μικρό ποσοστό ασθενών. Όλα τα ανωτέρω θα συνεχίσουν να είναι θέμα διαφωνίας για πολλά χρόνια ακόμη, λόγω της ελλείψεως διπλών τυφλών μελετών.
Τυπικές ηπατεκτομές με ευρεία όρια εκτομής δεν είναι πάντα απαραίτητες, τεχνικές δε όπως οι μη ανατομικές εκτομές ή και η εκπυρήνιση είναι αποδεκτές επιλογές. Ο συνδυασμός διαφόρων τεχνικών και μεθόδων θεραπείας και δη όσον το δυνατόν νωρίτερα σε αυτήν την πρακτικά κυτταρομειωτική θεραπεία, είναι αποδεκτός με καλά αποτελέσματα (RFA, κρυοθεραπεία κ.λπ.). Θεραπευτική εγχείρηση μπορεί να επιχειρηθεί μόνο στα πλαίσια οργανωμένης μονάδας χειρουργικής ήπατος και εάν οι βλάβες δεν καταλαμβάνουν περισσότερο από το 75% του ηπατικού παρεγχύματος, φυσικά όταν μπορεί να γίνει με ελάχιστη θνητότητα (μικρότερη του 2-5%). Τα καλύτερα αποτελέσματα επιτυγχάνονται σε ασθενείς που έχουν κατάληψη <50% της μάζας του ήπατος.
Έτσι λοιπόν λόγω αυτών των αδυναμιών δεν υπάρχουν σαφή και μη αμφισβητούμενα δεδομένα που να μας οδηγούν στο να αποφασίσουμε εύκολα αν οι ασθενείς πρέπει να υποβληθούν σε χειρουργική θεραπεία ή ακόμα ποια ομάδα από αυτούς θα ωφεληθεί. Αρκετοί στην προσπάθεια διαχωρισμού ομάδων που θα ωφεληθούν από τη χειρουργική επέμβαση χρησιμοποιούν το SRS για να αποκλείσουν την εξωηπατική νόσο. Θεωρούν δε ότι το θετικό για νόσο στο ήπαρ SRS (που σημαίνει ανάδειξη υποδοχέων σωματοστατίνης) σημαίνει και καλά διαφοροποιημένους όγκους και έτσι λιγότερο επιθετικούς. Οι ασθενείς αυτοί που θα υποβληθούν σε ηπατεκτομή (ανεξάρτητα από την έκταση της νόσου στο ήπαρ) και δεν αφαιρεθεί όλη η μάζα (R1 η R2 εκτομή) μπορεί να ωφεληθούν από τη μετεγχειρητική χρήση ανάλογων σωματοστατίνης (κυρίως σκευάσματα LAR) με αποτέλεσμα τον έλεγχο πιθανόν συμπτωμάτων του κλινικού συνδρόμου και ακόμη και συρρίκνωση του όγκου. Αν δεν έχουν θετικό SRS (10-20%) δεν υποβάλλονται σε χειρουργική επέμβαση, οι δε ασθενείς λόγω της επιθετικότητας του όγκου θεραπεύονται με άλλες συντηρητικές μεθόδους και κυρίως χημειοθεραπεία.
Συμπερασματικά λοιπόν φαίνεται ότι ασθενείς με προχωρημένη νόσο έχουν χωρίς χειρουργική θεραπεία 5ετή επιβίωση 50-80%. Όμως όλες οι μελέτες μας δείχνουν ότι η χειρουργική θεραπεία της μεταστατικής νόσου του ήπατος από NETs με σκοπό την R0 εκτομή μπορεί να γίνει με ασφάλεια, χαμηλή νοσηρότητα και θνητότητα, δύναται δε να επιφέρει βελτίωση της επιβίωσης αυτής και περιστασιακή και οριστική θεραπεία, σε μια νόσο που απλά η φυσική πορεία της είναι ούτως ή άλλως μικρή.
Παρόλα αυτά όμως, για πολλούς και δη γαστρεντερολόγους και ογκολόγους, η ανακάλυψη μεταστάσεων σηματοδοτεί στροφή της θεραπείας προς την παρηγορική της πλευρά (συνδυασμός χημειοθεραπείας με ανάλογα σωματοστατίνης).
Έτσι σήμερα και εμείς μεταξύ άλλων πιστεύουμε ότι λόγω της χαμηλής αποτελεσματικότητας της συντηρητικής θεραπείας στη μεταστατική νόσο του ήπατος από NETs, η επιθετική χειρουργική θεραπεία με σκοπό την R0 εκτομή σε κάθε ασθενή με τη νόσο και όταν ένα τουλάχιστον 90% της μάζας των μεταστάσεων μπορεί να εξαιρεθεί, είναι η καλύτερη δυνατή θεραπεία και πρέπει να είναι η πρώτη επιλογή για τους ανωτέρω ασθενείς παρ’ όλο που δεν είναι η ιδανική.
Η ηπατική μεταμόσχευση για μεταστατική νόσο από νευροενδοκρινείς όγκους άρχισε αρκετά παλιά στο ΤΕ Starzl Institute, USA και αρκετές προσπάθειες έχουν γίνει από τότε. Ο ρόλος της ηπατικής μεταμόσχευσης ενδείκνυται όταν απειλείται η ζωή των ασθενών αυτών από τη νόσο του ήπατος ή η ποιότητα της ζωής τους είναι αφόρητη. Προαπαιτείται η απουσία εξωηπατικής νόσου (έλεγχος με SRS) και φυσικά να έχει γίνει η εξαίρεση του πρωτοπαθούς όγκου. Μια σχετικά πρόσφατη αναδρομική μελέτη σε ασθενείς με κακοήθη PNETs και μεταστατική νόσο αποκλειστικά στο ήπαρ που υπεβλήθησαν σε ΜΗ, έδειξε ότι η πενταετής επιβίωση είναι περίπου 45%, πράγμα αρκετά ενθαρρυντικό. Ίσως υπάρχει ένδειξη για ΜΗ για τη νόσο αυτή, ειδικά σε νέους ασθενείς. Η εμπειρία είναι ακόμη μικρή και έτσι η ΜΗ δεν μπορεί να θεωρηθεί ότι είναι θεραπευτική επιλογή ρουτίνας. Η 5ετής επιβίωση των ασθενών αυτών είναι καλή και κυμαίνεται από 40-80% σε μια πρόσφατη ανασκόπηση, αφορά δε όχι μόνο ασθενείς με γαστρίνωμα αλλά και αυτούς με όλα τα NETs του πεπτικού.
Μείωση της µάζας του όγκου
Όταν δεν πληρούνται οι προϋποθέσεις για R0 και R1 εκτομή της μεταστατικής νόσου και της πρωτοπαθούς εστίας και υπάρχουν λειτουργικά προβλήματα υπερπαραγωγής ορμόνης (καρκινοειδές σύνδρομο, υπογλυκαιμία κ.λπ.) που δεν μπορούν να ελεγχθούν επαρκώς με τη συντηρητική θεραπεία, μπορεί κανείς να επιχειρήσει παρηγορητική επέμβαση, αν φυσικά ο προεγχειρητικός έλεγχος υποδηλοί ότι τουλάχιστον το 90% του όγκου μπορεί να αφαιρεθεί με ελάχιστο κίνδυνο.
Συμπερασματικά λοιπόν φαίνεται ότι ασθενείς με προχωρημένη νόσο έχουν χωρίς χειρουργική θεραπεία 5ετή επιβίωση 50-80%. Όμως όλες οι μελέτες μας Έτσι λοιπόν στο γαστρίνωμα, και σε άλλους κακοήθεις μεταστατικούς όγκους του ήπατος από PNETs και NETs, έχουν χρησιμοποιηθεί η παρηγορική χειρουργική θεραπεία των ηπατικών μεταστάσεων με ηπατεκτομή, θερμο- και κρυοκαταστροφή και άλλες τεχνικές. Έτσι λοιπόν μπορεί να επιχειρηθεί εξαίρεση του όγκου και των μεταστάσεων και εάν αυτό δεν είναι εφικτό, δύναται να γίνει εξαίρεση του μεγαλύτερου ποσοστού της μάζας [κυτταρομειωτική θεραπεία (debulking)] που είναι μια καλή επιλογή και μπορεί να είναι επέμβαση σωτηρίας. Η συμπτωματική ανακούφιση από την ορμονική υπερέκκριση συσχετίζεται με τη μείωση του όγκου. Ανταπόκριση στην ηπατεκτομή είναι εμφανής μέχρι και στο 90% των ασθενών με μέση διάρκεια 19,3-45,5 μηνών. Οι περισσότεροι ασθενείς υποτροπιάζουν μετά από επέμβαση τέτοιου είδους (πιθανότητα υποτροπής 84-91% στα 5 χρόνια με μέσο χρόνο τους 16-20 μήνες αναλόγως του είδους της επέμβασης (R0, R1 ή παρηγορική εκτομή). Οι γνώμες όμως και στο θέμα αυτό διχάζονται μιας και πολλοί ερευνητές υποστηρίζουν ότι σε περιπτώσεις που δεν είναι εφικτή η αφαίρεση όλου του νεοπλάσματος (R0 ή R1 εκτομή), η μερική εξαίρεσή του δεν έχει νόημα μια και δεν προσφέρει στην επιβίωση.
Κυτταρομειωτικές στρατηγικές άλλες από τη χειρουργική θεραπεία ενδείκνυνται σε ασθενείς με ηπατικές μεταστάσεις:
- Εμβολισμός: δεν συστήνεται πλέον.
- Ο ραδιοεμβολισμός είναι μια ακόμη πειραματική θεραπεία για ηπατικές μεταστάσεις, συνίσταται δε σε εμβολισμό των κλάδων της ηπατικής αρτηρίας με έγχυση μικροσφαιριδίων σεσημασμένα με ραδιοϊσότοπα (brachyradiotherapy). Η ύπαρξη όμως της Somatostatin Receptor Radionuclide Therapy (SRRT) που θα αναφέρουμε πιο κάτω κάνει τη μέθοδο αυτή να μην είναι πλέον στη θεραπευτική μας φαρέτρα.
- Εκλεκτικός αρτηριακός χημειοεμβολισμός: η διαδικασία περιλαμβάνει παροδική αλλά τέλεια ισχαιμία σε συνδυασμό με χημειοθεραπεία, επαναλαμβάνεται δε περιοδικά σε συνδυασμό ή όχι με ηπατεκτομή, και δεν έχει αποδείξει παρατεταμένη επιβίωση. Έχει αυξημένη νοσηρότητα και θνητότητα ενώ δεν αποδεικνύει ότι νεκρώνει τον όγκο. Παραμένει όμως μια επιλογή σε πολύ ακραίες καταστάσεις, σαν το τελευταίο θεραπευτικό μέσο.
- Τοπική θεραπεία:a. Σήμερα μπορούμε μέσα στα πλαίσια πάντα της παρηγορικής θεραπείας να προσεγγίσουμε την μεταστατική νόσο του ήπατος με τις τοπικές μεθόδους καταστροφής (local ablative therapy). Ο ρόλος της θερμοκαταστροφής των όγκων αυτών με RFA (radiofrequency ablation) ήδη μελετάται ως η μέθοδος εκλογής στα περισσότερα κέντρα με σχετικά καλά αποτελέσματα, η δε μέθοδος προτιμάται της κρυοθεραπείας. Η καταστροφή με RF, όπως έχουμε αναφέρει, προτιμάται να γίνεται διεγχειρητικά (ανοικτά ή λαπαροσκοπικά) με καθοδήγηση υπερηχογράφου και το μέγεθος του όγκου είναι ένας από τους περιοριστικούς παράγοντες. Η μέθοδος είναι αποτελεσματική και για εξωηπατικούς όγκους και σε λειτουργικούς και μη λειτουργικούς όγκους. Κυρίως προσφέρει στη διενέργεια αφελέστερων ηπατεκτομών με καλύτερα χειρουργικά όρια, ως RFA υποβοηθούμενη ηπατεκτομή. Βελτίωση των συμπτωμάτων μπορεί να επιτευχθεί στο 95% των ασθενών παρόλο που μακρόχρονα αποτελέσματα δεν είναι ακόμη γνωστά. Η νοσηρότητα και η θνητότητα είναι πολύ μικρές (<5%). Όμως δεν υπάρχουν ακόμη σαφή δεδομένα για την επιβίωση, μια και σαν μέθοδος είναι καινούργια.b. Η κρυοθεραπεία είναι μια δεύτερη επιλογή παρ’ όλο που δεν υπάρχει ακόμη ασφαλής και επαρκής βιβλιογραφία ειδικά για τους νευροενδοκρινείς όγκους. Δεν υπάρχουν επίσης καθόλου δεδομένα για τη θερμοκαταστροφή με laser [laser induced thermal therapy (LITT)] σε νευροενδοκρινείς όγκους.c. Η έγχυση αλκοόλης δεν έχει δοκιμασθεί αρκετά.
Ενώ η παρηγορική θεραπεία της μεταστατικής νόσου του ήπατος λοιπόν ενδείκνυται, η εκτομή μόνο του πρωτοπαθούς όγκου χωρίς την παρηγορική τουλάχιστον εκτομή των μεταστάσεων δεν προσφέρει στην επιβίωση των ασθενών. Όμως στα PNETs με ηπατικές μεταστάσεις αλλά και σε όλα τα NETs προερχόμενα από το μέσο έντερο (midgut), η εκτομή της πρωτοπαθούς εστίας είναι σωστή ως σκέψη ώστε να προληφθεί η εντερική απόφραξη ή οι ισχαιμικές επιπλοκές από τη ρίκνωση του μεσεντερίου ή τη θρόμβωση της πυλαίας φλέβας λόγω της μάζας του όγκου. Τα δεδομένα βέβαια αλλάζουν συνέχεια και θα συνεχίσουν να αλλάζουν, μια και δεν έχει μελετηθεί η περίπτωση του συνδυασμού της εκτομής της πρωτοπαθούς εστίας με Somatostatin receptor radionuclide therapy (SRRT).
Έτσι λοιπόν η κυτταρομειωτική θεραπεία (R2 εκτομή) σκοπό έχει:
- να γίνεται όταν δεν υπάρχει ανταπόκριση στη χημειοθεραπεία και γενικά στη συντηρητική θεραπεία
- να βελτιώσει την ανταπόκριση στη χημειοθεραπεία
- τη βελτίωση των συμπτωμάτων από την πρωτοπαθή ή/και τη μεταστατική μάζα του ήπατος, και
- τη βελτίωση των συμπτωμάτων του κλινικού συνδρόμου.
Συντηρητική θεραπεία – Εξελίξεις
Η συντηρητική θεραπεία πρέπει πάντα να είναι συμπληρωματική της χειρουργικής, εκτός εάν υπάρχουν αντενδείξεις στη χειρουργική επέμβαση ή ο ασθενής δεν κρίνεται κατάλληλος για επέμβαση λόγω βαρείας γενικής κατάστασης. Οι ασθενείς επανεξετάζονται και επανελέγχονται κάθε 3-6 μήνες για την πρόοδο της νόσου (κλινικά, βιοχημικά και ακτινολογικά). Έτσι, ασθενείς με καλά διαφοροποιημένα PNETs πρέπει να θεραπεύονται με SSA, εφόσον αυτά εκφράζουν υποδοχείς σωματοστατίνης, για τον περιορισμό του μεγέθους του όγκου (παρόλο που η χρησιμότητα της άποψης αυτής δεν είναι ακόμα τελείως ξεκάθαρη) ή ιντερφερόνη-α και αναλόγως να προστίθεται χημειοθεραπεία ή και άλλες μέθοδοι θεραπείας.
Συντηρητική θεραπεία µεταστατικού γαστρινώµατος στο ήπαρ
- Βιοθεραπεία: Δεν υπάρχουν σαφή δεδομένα (Ως βιοθεραπεία για τη συγκεκριμένη νόσο ορίζεται η θεραπεία των ορμονικών συνδρόμων ή/και της αύξησης όγκων με τις ουσίες ή φαρμακολογικά παράγωγα αυτών, που είναι φυσικά προερχόμενες από το ανθρώπινο σώμα).
- Ανάλογα σωματοστατίνης (SSA): Η σωματοστατίνη είναι η μοναδική ορμόνη που εμφανίζει εξειδικευμένη καταστολή ιστών και όγκων μέσω της καταστολής της έκκρισης των ορμονών και των νευροδιαβιβαστών που προκαλεί. Επίσης προκαλεί ελάττωση των αυξητικών παραγόντων όπως ο insulin-like growth factor-I (IGF-I) και το γαστρικό ανασταλτικό πεπτίδιο (GIP). In vitro, υψηλές συγκεντρώσεις σωματοστατίνης προκαλούν απόπτωση σε κύτταρα όγκων. Αυτοί οι μηχανισμοί και ίσως και πολλοί άλλοι είναι υπεύθυνοι για τις αντινεοπλασματικές ιδιότητες της σωματοστατίνης και των αναλόγων της. Μια και τα περισσότερα NETs είναι εμπλουτισμένα με υποδοχείς σωματοστατίνης σε σχέση με τους περιβάλλοντες ιστούς, η θεραπεία με τα ανάλογα της σωματοστατίνης είναι σχεδόν ειδική. Στους περισσότερους ασθενείς η θεραπεία με τα SSA είναι αποτελεσματική μόνο για 8-12 μήνες λόγω διαφυγής, ενός μέχρι τώρα ανεξήγητου φαινομένου. Εντούτοις, μερικοί ασθενείς ανταποκρίνονται καλά για χρόνια στα SSA. Τα συμπτώματα βελτιώνονται κυρίως σε ασθενείς με καρκινοειδές σύνδρομο, υδαρή διάρροια ή γλυκαγόνωμα. Η αντινεοπλασματική επίδραση των ανάλογων σωματοστατίνης έχει καταδειχθεί λιγότερο πειστικά. Μερική ή και πλήρης απάντηση έχει παρατηρηθεί σε λιγότερο από 10% των ασθενών. Συνολικά 30 ασθενείς με μερική υποστροφή όγκων έχουν αναφερθεί μέχρι τώρα. Επιπλέον, η θεραπεία με τα ανάλογα σωματοστατίνης LAR (όπως η οκτρεοτίδη ή η λαντρεοτίδη που έχουν υψηλή συγγένεια κυρίως προς τους υποδοχείς 2 και 5 της σωματοστατίνης, SSTR 2, 5) μόνο σε μερικούς ασθενείς με καρκινοειδείς όγκους (10% 17%) προκαλεί μια μείωση της μάζας του όγκου ειδικά. Ίσως σε αυτούς τους όγκους η χειρουργική επέμβαση να καθίσταται περιττή. Η θεραπεία με SSA συνδέεται με λίγες παρενέργειες. Σταθεροποίηση της αύξησης όγκων, που τεκμηριώνεται από την ΑΤ, εμφανίζεται στο 50-80% των ασθενών και σε 24-57% αυτών με πρόοδο των όγκων πριν από τη θεραπεία με σωματοστατίνη. Κατά συνέπεια, τα ανάλογα σωματοστατίνης σαφώς ενδείκνυνται για συμπτωματική θεραπεία σε λειτουργικούς νευροενδοκρινείς όγκους με καρκινοειδές σύνδρομο, υδαρή διάρροια ή ασθενείς με γλυκαγόνωμα. Εάν τα ανάλογα σωματοστατίνης εμποδίζουν την αύξηση ή προκαλούν μείωση των όγκων πρέπει να αποδειχθεί. Εάν το νέο SSA, SOM230, που έχει υψηλή συγγένεια με τους υποδοχείς SSTR 1, 2, 3 και 5 διαθέτει ικανοποιητική δράση στη θεραπεία των νευροενδοκρινών όγκων είναι επίσης υπό έρευνα.
- Ιντερφερόνη: Η ιντερφερόνη δίνεται με τις ίδιες ενδείξεις με τα ανάλογα σωματοστατίνης, με εξαίρεση την καρκινοειδή κρίση. Λόγω παρενεργειών η ιντερφερόνη χρησιμοποιείται γενικά ως δεύτερη σειρά θεραπείας πάντα για συμπτωματικό έλεγχο και ακόμη περισσότερο από τα SSA, δεν υπάρχουν ικανοποιητικές πληροφορίες για μείωση της αύξησης των όγκων. Ο συνδυασμός των SSA και της ιντερφερόνης-άλφα δεν αυξάνει τη θεραπευτική αποτελεσματικότητα.
- Συστηματική χημειοθεραπεία: Η χημειοθεραπεία είναι κατά ένα μεγάλο μέρος αναποτελεσματική (συνδυασμός doxorubicin, streptozotocin και 5-FU) για τους καλά διαφοροποιημένους μεταστατικούς νευροενδοκρινείς όγκους αλλά έχει κάποια επίδραση σε ασθενείς με αδιαφοροποίητους όγκους ειδικά με τη χρήση συνδυασμού cisplatin και etoposide. Σήμερα υπάρχουν και νεότερες θεραπευτικές μέθοδοι που μπορετέ να δείτε εδώ.
- Θεραπεία με ραδιενεργά ανάλογα σωματοστατίνης (Somatostatin receptor radionuclide therapy, SRRT): Η σήμανση των SSA με ραδιενεργά ισότοπα κατευθύνει τα ισότοπα αυτά στους υποδοχείς της σωματοστατίνης για την ακτινοβολία των όγκων που εκφράζουν αυτούς τους υποδοχείς. Έτσι υπάρχουν πάντα σε ερευνητικό επίπεδο ικανοποιητικά αποτελέσματα με τα παράγωγα 90Y-DOTA-Tyr-octreotide και 177Lu-DOTA-Tyr3-octreotate. Ο μέσος χρόνος μέχρι την αύξηση του μεγέθους των όγκων και αυτός της γενικής επιβίωσης σε ασθενείς με επιθετική νόσο στην έναρξη της θεραπείας, ήταν 30 και >59 μήνες για θεραπεία 90Y-DOTA-Tyr3 octreotide και >30 μήνες και για τα δύο με 177Lu-DOTATyr3 octreotate, αντίστοιχα. Η τοξικότητα είναι αρκετά σημαντική.
- Η εξωτερική ακτινοβολία χορηγείται πλέον μόνο για τη θεραπεία των συμπτωματικών οστικών μεταστάσεων.
Αυτή τη στιγμή λοιπόν η συντηρητική θεραπεία από μόνη της (χημειοθεραπεία, βιολογική θεραπεία, ακτινοβολία, χημειοεμβολισμός κ.ά.) έχει περιορισμένη επιτυχία στην αύξηση της επιβίωσης και συνολικά ίσως έχει σημαντικές παρενέργειες. Το πιο αξιόλογο είναι οι ασθενείς με τα νοσήματα αυτά να αντιμετωπίζονται συνολικά με κάποια μέθοδο από μια ομάδα ιατρών που θα διαλέξει το συνδυασμό μεθόδων για να έχουν την καλύτερη δυνατή θεραπεία.
Φαρµακευτική αντιµετώπιση των λειτουργικών όγκων του παγκρέατος
Όπως αναφέρθηκε, η οριστική θεραπεία των F-pNETs του παγκρέατος επέρχεται μόνο με τη χειρουργική εξαίρεση της βλάβης. Συχνά όμως τη στιγμή της διάγνωσης η νόσος είναι αρκετά διασπαρμένη με πολλαπλές ηπατικές μεταστάσεις που καθιστούν την πλήρη εξαίρεσή της ανέφικτη.
Στις περιπτώσεις αυτές ο στόχος είναι η αντιμετώπιση των συμπτωμάτων που προκαλεί η υπερέκκριση της αντίστοιχης ορμόνης. Κάτι τέτοιο επιτυγχάνεται με τη χρήση ουσιών που αναστέλλουν την ορμονοεκκριτική δράση του.
Έτσι στην περίπτωση του ινσουλινώματος, χρησιμοποιείται η διαζοξίδη που αναστέλλει την έκκριση της ινσουλίνης από τα κύτταρα του όγκου. Στο σύνδρομο Zollinger-Ellison, οι αναστολείς της αντλίας πρωτονίων (ομεπραζόλη κ.λπ.) προσφέρουν σημαντικό έλεγχο στη δημιουργία των πεπτικών ελκών. Εκτός όμως από τις παραπάνω ουσίες που είναι ειδικές για κάθε όγκο, τα τελευταία χρόνια χρησιμοποιούνται με πολύ ενθαρρυντικά αποτελέσματα στην αντιμετώπιση των νευροενδοκρινών συνδρόμων και τα ανάλογα της σωματοστατίνης, όπως η οκτρεοτίδη.
Όπως αναφέρθηκε στην αρχή του κεφαλαίου οι περισσότεροι pNETs (90%), εκτός από το ινσουλίνωμα, φέρουν υποδοχείς σωματοστατίνης, οι δε υποδοχείς αυτοί μπορούν να μεταβιβάσουν τις ανασταλτικές ιδιότητες των αναλόγων της σωματοστατίνης στους όγκους. Όλα αυτά έχουν ως αποτέλεσμα η εξωγενής χορήγηση της ορμόνης να προκαλεί αναστολή της ορμονοεκκριτικής δράσης τους, σε πολύ μεγάλο ποσοστό. Έτσι, τα ποσοστά μείωσης των συμπτωμάτων με τη χορήγηση οκτρεοτίδης είναι για το γαστρίνωμα 50%, για το γλυκαγόνωμα 60% και για το VIPόμα 90%. Η μακροπρόθεσμη χρήση της οκτρεοτίδης και άλλων παραγώγων έχει τη μέγιστη αποτελεσματικότητά της στη θεραπεία των συμπτωμάτων των VIPομάτων και ειδικά στην αντιμετώπιση της διάρροιας.
Η σωματοστατίνη όπως έχει ήδη αναφερθεί συνδέεται με 5 διαφορετικούς υποδοχείς (SSTR 1-5), με αντίστοιχους διαφορετικούς ενδοκυττάριους μηχανισμούς μεταγωγής σημάτων. Η σωματοστατίνη που χρησιμοποιείται στην κλινική πράξη συνδέεται με τους SSTR 2 και 5. Τα ανάλογα σωματοστατίνης (SSA) μακράς δράσεως έχουν ανάλογη δράση και δεδομένου ότι οι περισσότεροι νευροενδοκρινείς όγκοι εκφράζουν τους υποδοχείς, η θεραπεία με SSA είναι ουσιαστικά ειδική για τους όγκους αυτούς. Μεμονωμένες μελέτες αναδεικνύουν επίσης μια ήπια αντινεοπλασματική δράση της ανωτέρω ορμόνης, αυτό όμως δεν μπορεί ακόμα να υποστηριχθεί με ασφάλεια, μια και αξιόλογη κυτταροστατική δράση βρέθηκε μόνο σε σπάνιους ασθενείς με VIPόμα ή GRFόμα. Στους περισσότερους ασθενείς η θεραπεία με SSA είναι αποτελεσματική μόνο για 8-12 μήνες, λόγω ενός μέχρι τώρα ανεξήγητου φαινομένου διαφυγής, όπως αναφέρθηκε. Εντούτοις, μερικοί ασθενείς ανταποκρίνονται καλά για χρόνια στη χορήγηση SSA. Γενικά φαίνεται ότι η οκτρεοτίδη μπορεί να μικρύνει το μέγεθος ενός νευροενδοκρινούς όγκου στο 10-17% των ασθενών, αν και αυτό δεν είναι ακόμη σίγουρο και μένει να αποδειχθεί με περαιτέρω μελέτες. Η σταθεροποίηση της νόσου όμως μπορεί να γίνει στο 50-80% των ασθενών με μεταστατική νόσο. Τέτοια αποτελέσματα έχουν δειχθεί και με τα μακράς δράσεως ανάλογα της σωματοστατίνης. Με αυτόν τον τρόπο τα SSA μπορούν να ελέγξουν πολύ καλά αφ’ ενός μεν το κλινικό σύνδρομο, αφ’ ετέρου δε να έχουν κυτταροστατική δράση εναντίον του όγκου, περιορίζοντας το ρυθμό πολλαπλασιασμού του, ειδικά στα λειτουργικά pNETs. Δεν υπάρχει όμως καμία σαφής απόδειξη ότι η χορήγηση των SSA επιμηκύνει την επιβίωση των ασθενών, ούτε είναι ακόμα σαφές αν η θεραπεία αυτή ενδείκνυται και για ασθενείς με μη λειτουργικά PNETs. Η θεραπεία αρχίζει ενδεικτικά με οκτρεοτίδη σε ημερήσιες δόσεις 200-450 mg, μπορεί δε να ανέλθει μέχρι και σε δόσεις >3000 mg/ημ., αν οι κανονικές δοσολογίες αποτύχουν, φυσικά επιβαρύνοντας πολύ σημαντικά το κόστος. Υπάρχουν και απόψεις ότι μπορεί να γίνεται χορήγηση SSA μακράς δράσεως σε δόσεις 30-60 mg κάθε 3-4 εβδομάδες.
Εκτός από τους παράγοντες που χρησιμοποιούνται για την τροποποίηση της βιολογικής δράσης των νησιδιακών όγκων του παγκρέατος, η στόχευση των διαφόρων ερευνητών κατευθύνεται και προς την ανεύρεση ουσιών που προκαλούν αναστολή της ανάπτυξής τους, δηλαδή αντινεοπλασματικών ουσιών. Σε αυτή την κατηγορία ανήκουν οι χημειοθεραπευτικοί παράγοντες και η ιντερφερόνη.
Η ιντερφερόνη-α έχει δοκιμαστεί και έχει δώσει κάποια θετικά αποτελέσματα κυρίως στη θεραπεία των γαστρινωμάτων. Ο έλεγχος των συμπτωμάτων, αν και σε μακρύτερο χρόνο, είναι συγκρίσιμος με τα ανάλογα σωματοστατίνης. Σε μια μελέτη με 322 ασθενείς με διάφορα PNETs που έλαβαν ιντερφερόνη-α, το 43% παρουσίασαν βιοχημική ανταπόκριση (>50% μείωση των επιπέδων της ορμόνης), ενώ 12% εμφάνισαν και μείωση του μεγέθους του όγκου με μέση διάρκεια 20 μηνών. Η σταθεροποίηση της νόσου επιτεύχθηκε στο 75-80% των ασθενών με μεταστατική νόσο. Το αποτέλεσμα αυτό επιτυγχάνεται πιθανόν μέσω της αύξησης της έκφρασης του bcl-2 με επακόλουθη σταθεροποίηση των κυττάρων του όγκου στη φάση G0 του κυτταρικού κύκλου. Είναι άγνωστο όμως και μάλλον απίθανο αν η ιντερφερόνη όπως και η σωματοστατίνη παρατείνουν την επιβίωση. Εδώ οι απόψεις διίστανται, ενώ πιο πρόσφατα επιχειρήθηκε ο συνδυασμός ιντερφερόνης και αναλόγων σωματοστατίνης χωρίς όμως καλύτερα αποτελέσματα. Λόγω αρκετών αλλά όχι ιδιαίτερα σημαντικών παρενεργειών, η ιντερφερόνη χρησιμοποιείται γενικά ως θεραπεία δεύτερης γραμμής για το συμπτωματικό έλεγχο.
Όλα τα pNETs εκτός από τα ινσουλινώματα (10%) και τα GRFόματα (30%) έχουν ένα ποσοστό κακοήθειας μεγαλύτερο από 60%. Τα χημειοθεραπευτικά φάρμακα που έχουν μελετηθεί (δυστυχώς χωρίς ιδιαίτερα ενθαρρυντικά αποτελέσματα μέχρι τώρα), είναι η 5FU, η στρεπτοζοτοκίνη, η χλωροζοτοκίνη, η doxorubicin και η διμεθυλοτριαζενοιμιδαζόλη (DTIC), μόνα ή σε συνδυασμό δίνουν ανταπόκριση από 0-26%, η οποία όμως αναπτύσσεται βραδέως. Η αποτελεσματικότητα της συστηματικής χημειοθεραπείας είναι υψηλότερη στους ταχέως αναπτυσσόμενους (Ki-67 >10%) και τους κακώς διαφοροποιημένους όγκους, όπως έχει δειχθεί με το συνδυασμό cisplatin και etoposide και είναι ουσιαστικά η μοναδική εναλλακτική λύση στα ΕΝΠ αυτά. Ασθενείς με λειτουργικούς όγκους ανταποκρίνονται καλύτερα από τους μη λειτουργικούς. Θεωρείται ότι η συστηματική χημειοθεραπεία για καλά διαφοροποιημένους όγκους ενδείκνυται για ασθενείς που στην παρακολούθηση επιδεικνύουν σχετικά ταχεία αύξηση του όγκου. Αν αυτοί οι ασθενείς υποτροπιάσουν μετά τη χειρουργική επέμβαση είναι καλοί υποψήφιοι για συντηρητική αντιμετώπιση. Υπάρχουν ακόμη αναφορές για χρήση της θαλιδομίδης ως αντιαγγειογενετικοί παράγοντα, καθώς και των ανταγωνιστών του VEGF (αυξητικού παράγοντα του αγγειακού ενδοθηλίου).
Τα περισσότερα pNETs εκφράζουν τον υποδοχέα σωματοστατίνης SSTR2 στην κυτταρική τους μεμβράνη που μπορούν να γίνουν στόχος ακτινοθεραπείας. Σχετικά πρόσφατα αναπτύχθηκε ένα έντονο ενδιαφέρον στη χρήση ραδιοσεσημασμένων αναλόγων σωματοστατίνης, όπως [111 In-DTPA0] οκτρεοτίδη και τα [90] Y-σεσημασμένα ανάλογα σωματοστατίνης, συνδυασμένα με DOTA chelator, καθώς και άλλων νεοτέρων ραδιοσεσημασμένων ουσιών, για την ακτινοθεραπεία των όγκων αυτών [Somatostatin Receptor Radionuclide Therapy (SRRT)]. Η ένδειξη αυτής της θεραπείας είναι φυσικά για ασθενείς που οι όγκοι τους εκφράζουν τους υποδοχείς αυτούς στο διαγνωστικό σπινθηρογράφημα είτε μετά τη χειρουργική επέμβαση είτε όταν οι άλλες θεραπείες αποτύχουν. Η θεραπεία με αυτά τα ραδιοφάρμακα είναι ακόμα σε πειραματικό στάδιο και όλοι οι ασθενείς πρέπει να περιλαμβάνονται σε κλινικά πρωτόκολλα. Τα αποτελέσματα αναμένεται να βελτιωθούν στο μέλλον με νεότερα και πιο εκλεκτικά φάρμακα, ειδικά για κάθε όγκο και υποδοχέα σωματοστατίνης. Η χορήγηση των φαρμάκων αυτών πρέπει να συνοδεύεται από σύγχρονη χορήγηση αμινοξέων για να προστατευθούν οι νεφροί από τις παρενέργειες της ακτινοβολίας. Η θεραπεία με 131I-MIBG δεν είναι αποδοτική, μια και από τις λίγες περιπτώσεις που έχουν αναφερθεί, φαίνεται ότι τα PNETs δεν έχουν καλή πρόσληψη του ραδιοφαρμάκου.
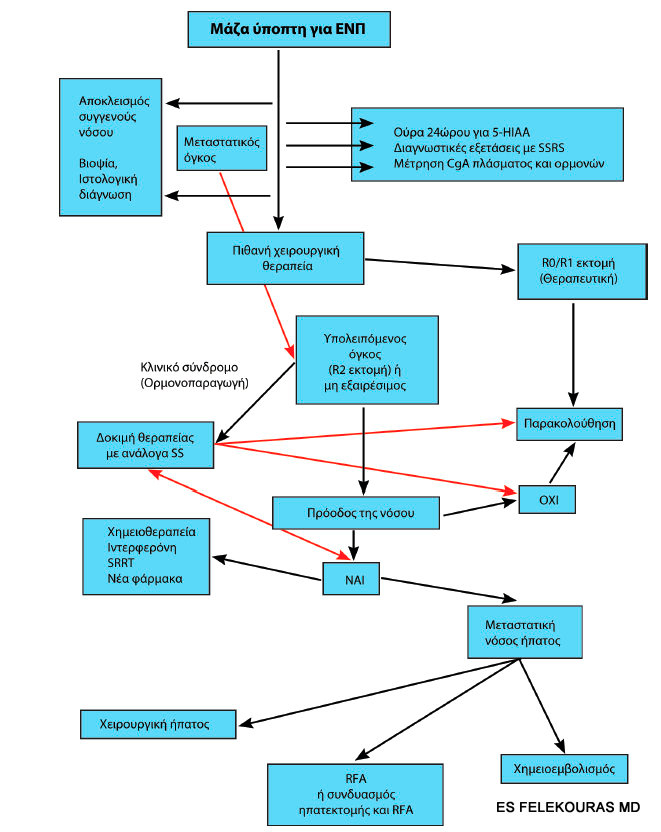
Συμπερασματικά θα θέλαμε να τονίσουμε ότι στη θεραπεία των λειτουργικών PNETs που έχουν σχετικά καλή πρόγνωση και μακρό διάστημα επιβίωσης, κυριαρχεί η χειρουργική θεραπεία και η χρήση των αναλόγων σωματοστατίνης. Κάθε ασθενής πρέπει να θεραπεύεται στα πλαίσια αυτά από καλά οργανωμένες ομάδες χειρουργών, ενδοκρινολόγων, ακτινολόγων, πυρηνικών ιατρών και γαστρεντερολόγων, ώστε να εκτιμώνται σωστά οι ανάγκες τους και η θεραπεία να εξατομικεύεται. Έτσι επιτυγχάνονται τα καλύτερα δυνατά αποτελέσματα, με τη μεγίστη διάρκεια επιβίωσης. Ακολουθεί ένας αδρός αλγόριθμος διερεύνησης και αντιμετώπισης γενικά τέτοιων όγκων (Εικόνα 2).
Εικόνα 2. Αλγόριθμος διερεύνησης και θεραπείας pNETs.